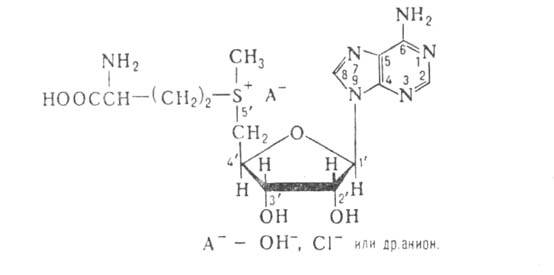
S-АДЕНОЗИЛМЕТИОНИН [S-(5'-дезоксиаденозин-5'-ил)-метионин,
активный метионин; активный метил], донор метильных групп при трансметилировании
(переносе метильных групп на разл. соединения-акцепторы), происходящем в клетках
животных и растений. Мол. масса катиона А. 398,4;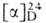 48,5° (1,8 г в 100 мл 5н. НС1);
48,5° (1,8 г в 100 мл 5н. НС1);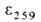 15,4*103. Группа СН3 у атома S легко отщепляется; энтальпия
р-ции 41,868 кДж/моль. .
15,4*103. Группа СН3 у атома S легко отщепляется; энтальпия
р-ции 41,868 кДж/моль. .
А. участвует в синтезе фосфатидилхолина, холина, адреналина, витамина В12 и др. Механизм трансметилирования-нуклеоф. замещение под действием ферментов группы метилтрансфераз, специфичных к акцепторам метильной группы. Метилируются обычно атомы N и О, реже-С.
Перенос метильных групп на двойные связи ненасыщ. жирных к-т микроорганизмов приводит к образованию к-т с разветвленной цепью или содержащих циклопропановые кольца. В результате метилирования нек-рых биологически активных соед. (напр., гистамина, никотинамида) образуются продукты, выводимые из организма. В белках метилированию могут подвергаться аминогруппы остатков лизина и аргинина. Метилирование пуриновых и пиримидиновых оснований, а также рибозных колец - самая распространенная модификация нуклеиновых к-т, особенно транспортных РНК. В полисахаридах А. может, напр., метилировать атом О в положении 6 остатков D-глюкозы.
При элиминировании метильной группы А. превращается в S-аденозил-L-гомоцистеин, к-рый гидролизуется до аденозина и гомоцистеина HSCH2CH2CH(NH2)COOH. Последний м.б. в организме метилирован при участии N5-метилтетрагидрофолиевой к-ты с образованием метионина, к-рый вновь может включаться в состав А. Известны и другие пути метаболизма S-аденозил-L-гомоцистеина: у млекопитающих - расщепление с образованием гомосерина, аденина и 5-метилтиорибозо-1-фосфата, у микроорганизмов-дезаминирование аденозинового или гомоцистеинового фрагментов молекулы, а также отщепление аденина.
А. служит также донором аминопропильных фрагментов при биосинтезе аминов-спермина H2N (CH,)3NH (CH2)4NH (CH2)3NH, и спермидина H2N(CH2)3NH(CH2)4NH2, а также донором аминогруппы при синтезе биотина. Установлена регуляторная ф-ция А. для нек-рых ферментов: воздействие А. на одну из субъединиц фермента (напр., в результате переноса аденозильного остатка) меняет сродство к субстрату у другой.
Синтез А. в организме осуществляется замещением фосфорной компоненты АТФ L-метионином с отщеплением пирофосфорной и ортофосфорной к-т. Р-ция катализируется метионин-аденозилтрансферазой. Таким же образом осуществляют препаративный синтез А.
Лит.: Lorn bardini J. В., Talalay P., "Advances in Enzyme Regulation",
1971, v. 9, p. 349-84; Cantoni G.L., "Annual Review of Biochemistry", 1975,
v. 44, p. 435-51; UsdinE., Biochemistry of S-adenosylomethionine and related
compounds, L, 1982. Н.В.Гуляева.


