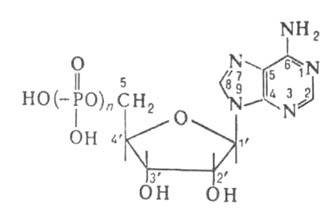
АДЕНОЗИНФОСФОРНЫЕ КИСЛОТЫ (адениновые рибонуклеотиды),
производные аденозина, содержащие остатки ортофосфорной или полифосфорных
к-т в разл. положениях рибозного кольца. Большинство А.к. имеют важное
биол. значение; особое место занимают аденозин-5'-фосфорные к-ты (см. ф-лу)-моно-,
ди- и трифосфорные (n-соотв. 1, 2, 3), обозначаемые АМФ, АДФ, АТФ (см.
табл.). К аденозин-5'-фосфорным относятся также менее изученные к-ты с
n = 4 и 5. Среди продуктов метаболизма нек-рых коферментов обнаружены аденозин-2',5'-
и аденозин-3',5'-дифосфорные к-ты. К А.к. относятся также аденозинмонофосфат
циклический и диаденозинтетрафосфорная к-та, играющие регуляторную
роль в обмене в-в. При щелочном гидролизе РНК образуется смесь аденозин-2'-и
аденозин-З'-монофосфор-ных к-т. Аденозин-5'-фосфорные к-ты имеют характерный
оптич. спектр с максимумом в области 260 нм и минимумом при 230 нм. Это
к-ты средней силы (рК'а ~ 1).
ХАРАКТЕРИСТИКИ АДЕНОЗИН-5-ФОСФОРНЫХ КИСЛОТ
|
Показатель
|
АМФ
|
АДФ
|
АТФ
|
|
Мол. м.
|
347,23
|
427,22
|
507,21
|
|
Т. пл., °С
|
196-200
|
215*
|
143-145 (с разл.)**
|
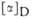 |
-41,78 (50 °С)
|
-25,7° (25 °С)
|
-26,7° (22 °С)
|
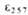 *10-3 при рН 2 .
*10-3 при рН 2 . |
15.1
|
15.0
|
14,7
|
|
рКa (аденин)
|
3,7
|
3,9
|
4,0
|
|
рК"а (к-та)
|
6,05
|
6,27
|
6,48
|
* Для моноакридиновой соли. ** Для мононатрисвой соли.
Они хорошо раств. в воде, плохо-в спирте, не раств. в большинстве орг. р-рителей. Соли щелочных металлов также раств. в воде (в отличие от солей тяжелых металлов). У АТФ средняя бариевая соль (Ва2АТФ) не раств. в воде, но раств. кислая.
В водных р-рах АДФ п АТФ неустойчивы. При 0°С АТФ стабильна в воде всего неск. часов. При кипячении в течение 10 мин в кислом р-ре АДФ и АТФ полностью расщепляются до АМФ и Н3РО4. Эта р-ция иногда используется для определения "лабильного фосфата". В разб. р-ре щелочи АТФ гидролизуется до АМФ и пирофосфорной к-ты Н4Р2О7. При длит, кипячении АМФ в щелочной или кислой среде образуются рибоза, аденин и фосфорная кислота.
Своб. энергия ( G°)
гидролиза АТФ, идущего с отщеплением концевого (терминального) остатка
Н3РО4, в стандартных условиях равна — 30,5 кДж/моль
при рН 7,0. Близкая величина найдена для гидролиза АТФ с отщеплением Н4Р2О7.
Абс. величина
G°)
гидролиза АТФ, идущего с отщеплением концевого (терминального) остатка
Н3РО4, в стандартных условиях равна — 30,5 кДж/моль
при рН 7,0. Близкая величина найдена для гидролиза АТФ с отщеплением Н4Р2О7.
Абс. величина G°
гидролиза АМФ значительно ниже ( — 12,6 кДж/моль).
G°
гидролиза АМФ значительно ниже ( — 12,6 кДж/моль).
Хим. св-ва аденозин-5'-фосфорных к-т определяются также функц. группами остатка аденозина. Так, для А. к. характерно дезаминирование под действием HNO2, приводящее к инозиновым производным. А. к. ацилируются по NH2-и ОН-группам. При галогенировании (обычно бромирова-нии) замещается атом Н в положении 8. Окисление АТФ и АДФ периодатом превращает их в диальдегид, образующийся в результате окислит. расщепления связи между атомами С в положениях 2' и 3'. Алкилируются А.к. обычно в положение 1 и по аминогруппе. Так, при действии 3-меркаптопропионовой к-ты и формальдегида атом Н в группе NH2 замещается на группировку CH2SCH2CH2COOH. N6-Карбоксиметильное производное АТФ получают перегруппировкой N1-карбоксиметил-АТФ, образующейся при р-ции АТФ с иодуксусной к-той. С помощью этиленоксида получают N1-гидроксиэтильные производные А. к. При взаимод. А. к. с хлоруксусным альдегидом по атому N в положении 1 алкилирование сопровождается циклизацией по аминогруппе с образованием трициклич. соед.-производного этеноаденозина; эти в-ва используют в кач-ве флуоресцентных меток при структурно-функциональном исследовании белков и нуклеиновых к-т.
Хим. модификация прир. А.к. используется для изучения механизма ферментативных р-ций. Модификация позволяет применять эти соед. в кач-ве ингибиторов, для образования ковалентных связей при изучении молекулярного окружения в точках связывания А. к. (так, 2',3'-диальдегидные производные образуют в активном центре ферментов альдиминные связи), для регистрации конформац. переходов в ферментах в ходе р-ции, напр. с помощью флуоресцентных или спиновых меток. Производные А.к. используют также для синтеза биоспецифич. адсорбентов, применяемых при выделении индивидуальных ферментов с помощью аффинной хроматографии, что имеет большое практич. значение в биотехнологии.
АТФ впервые была выделена из мышц в 1929 К. Ломаном; хим. синтез осуществлен А. Тоддом (1948) путем фосфорилирования АМФ и АДФ с помощью дибензил-хлорфосфата. Выделяют АТФ из скелетных мышц или дрожжей. АМФ и АДФ получают гидролизом АТФ, а АМФ также ферментативным фосфорилированием аденозина.
Для количеств. определения АМФ, АДФ и АТФ в живых организмах используют разл. виды хроматографии, ЯМР-спектроскопию и ферментативные р-ции. наиб. чувствит. метод-люминесцентный люциферин-люциферазный, в к-ром используется выделяемая из светляков люцифераза, катализирующая в присут. АТФ образование из люциферина люминесцирующего соединения. Метод позволяет определять АТФ в концентрации до 10 -13 М.
В живых организмах АТФ, АДФ и АМФ присутствуют в связанном с белками
состоянии и в виде комплексов с ионами Mg2+ и Са2+.
Скелетные мышцы млекопитающих содержат АТФ до 4 г/кг. У человека скорость
обмена АТФ составляет ок. 50 кг в сут. Такая интенсивность обмена объясняется
тем, что этот нуклеотид занимает центр. место в энергетике живых организмов.
Сокращение мышц, биосинтез белков и нуклеиновых к-т, многие др. процессы,
идущие с увеличением своб. энергии, сопряжены с гидролизом АТФ. Часть из
них проходит с отщеплением от АТФ Н3РО4, другая-Н4Р2О7.
В живой клетке G
гидролиза АТФ составляет - 50 кДж/моль. Сравнительно высокая абс. величина
G
гидролиза АТФ составляет - 50 кДж/моль. Сравнительно высокая абс. величина G°
гидролиза двух ангидридных связей в АТФ (макроэргич. связи) обусловливает
уникальное положение АТФ в метаболизме.
G°
гидролиза двух ангидридных связей в АТФ (макроэргич. связи) обусловливает
уникальное положение АТФ в метаболизме.
Исходный субстрат в биосинтезе АМФ-инозиновая к-та. АМФ, образующаяся также при пирофосфатном расщеплении АТФ, фосфорилируется в организме до АДФ при участии аденилаткиназы. Фосфорилирование АДФ, приводящее к синтезу АТФ в живых организмах, происходит при сопряжении этой р-ции с окислит.-восстановит. р-циями. Различают три типа сопряжения: в гликолизе (локализован в водной фазе клетки, в цитоплазме), при окислит, фосфо-рилировании и фотофосфорилировании в т. наз. сопрягающих мембранах субклеточных частиц (митохондрий и хло-ропластов) и бактерий.
Для сопряжения биохим. р-ций необходимо наличие общего для этих р-ций промежут. соединения (интермедиата). Так, в гликолизе окисление 3-фосфоглицеральдегида до фосфоглицериновой к-ты идет через стадию образования 1,3-дифосфоглицериновой к-ты, являющейся таким "макроэргич. интермедиатом". Ферментативная р-ция этого интермедиата с АДФ приводит к синтезу АТФ. Механизм сопряжения между фосфорилированием АДФ и электронным транспортом в сопрягающих мембранах установлен в 1960-х гг. П. Митчеллом. Было показано, что сопряжение осуществляется через посредство электрохим. потенциала ионов Н+. Особенность электрон-транспортных систем сопрягающих мембран-способность переносить Н + через мембрану. В то же время ферментативный комплекс, катализирующий синтез АТФ,-АТФ-синтетаза, может использовать энергию этого потенциала. Молекулярный механизм трансмембранного транспорта Н+ при окислительном фосфорилировании и фотофосфорилировании пока не выяснен. См. также Гликолиз, Окислительное фосфорилирование.
В высших организмах присутствует белковый комплекс, осуществляющий специфич. перенос через биол. мембраны АТФ в обмен на АДФ (транслоказа адениновых нуклеоти-дов) и являющийся первым хорошо изученным белком-переносчиком. Особая роль аденозин-5'-фосфорных к-т в биоэнергетике обусловливает то, что эти соед. являются также аллостерич. регуляторами ряда ключевых ферментов.
АМФ применяется в медицине при мышечной дистрофии, стенокардии и спазмах сосудов (мышечно-адениловый препарат). С той же целью иногда используют АТФ.
Лит.: Микельсон А. М., Химия нуклеозидов и нуклсотидов, пер.
с англ., М., 1966; Мецлср Д. Э., Биохимия, пер. с англ., т. 1, М., 1980.
К.Ф.
Шолъц.


