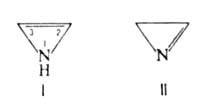
АЗИРИНЫ. Существуют в виде двух изомеров: 1Н-А. и 2Н-А. (соотв.
ф-лы I и II). В отличие от хорошо изученного 2Н-А. и его производных, 1Н-А.
известны лишь в виде интермедиатов или побочных продуктов, напр. в р-циях
присоединения нитренов к алкинам, вакуумного пиролиза триазолинов.
Большинство алкил- и арил-2Н-А.- нестабильные, дурно пахнущие, раздражающие
кожу в-ва. Не обладают основными св-вами и не раств. в разб. НС1; разлагаются
конц. НС1. Катализируемый к-тами гидролиз 2Н-А. приводит к аминокетонам:
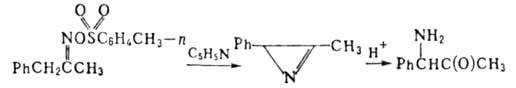
В безводной НСlO4 пооизволные 2H-А. ведут себя как карбкатионы Присоединение хлор-ангидридов и ангидридов карбоновых к-т по связи
Присоединение хлор-ангидридов и ангидридов карбоновых к-т по связи дает N-ацил-2H -замещенные азиридины, к-рые в мягких условиях перегруппировываются
в оксазолины или ацйклич. соединения. Восстановление 2H-А. с помощью LiAlH4-
удобный и стереоспецифич. синтез цис-азиридинов; каталитич. гидрирование
(катализаторы - Pd/C, Ni-Ренея) сопровождается расщеплением связи
дает N-ацил-2H -замещенные азиридины, к-рые в мягких условиях перегруппировываются
в оксазолины или ацйклич. соединения. Восстановление 2H-А. с помощью LiAlH4-
удобный и стереоспецифич. синтез цис-азиридинов; каталитич. гидрирование
(катализаторы - Pd/C, Ni-Ренея) сопровождается расщеплением связи 3-Арил-и 3-амино-2H-А. димеризуются под действием карбонилов металлов VI
гр., давая производные пиррола или индола. Реакционноспособная двойная
связь в 2H-А. легко участвует как 2
3-Арил-и 3-амино-2H-А. димеризуются под действием карбонилов металлов VI
гр., давая производные пиррола или индола. Реакционноспособная двойная
связь в 2H-А. легко участвует как 2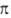 -компонента
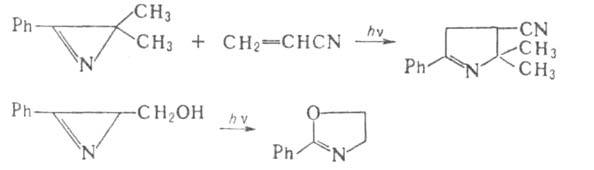
в диеновом синтезе. При фотолизе арил-2H-А. претерпевают необратимое раскрытие
цикла с образованием 1,3-диполярных нитрил-илидов, к-рые легко вступают
во внутри- или межмолекулярное 1,3-Диполярное циклоприсоединение, напр.:
-компонента
в диеновом синтезе. При фотолизе арил-2H-А. претерпевают необратимое раскрытие
цикла с образованием 1,3-диполярных нитрил-илидов, к-рые легко вступают
во внутри- или межмолекулярное 1,3-Диполярное циклоприсоединение, напр.:
Термолиз 2H-А. сопровождается обычно раскрытием связи
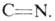
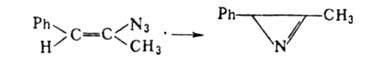
Общий метод синтеза 2H-А.-парофазный пиролиз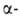 винил
азидов при 100-120°С или их фотолиз в атмосфере N2 при -30°С,
напр.:
винил
азидов при 100-120°С или их фотолиз в атмосфере N2 при -30°С,
напр.:
В связи с нестабильностью большинства 2H-А. р-ции с ними проводят путем их генерирования в реакц. среде.
Лит.: Общая органическая химия, пер. с англ., т. 8, М., 1985,
с. 687-97; Chemistry of hcterocyclic compounds, v. 42, pt 1, N.Y.-L., 1983.


