АЗОКСИСОЕДИНЕНИЯ, имеют общую формулу
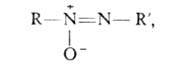
где R и R' - opг. радикалы. Существуют в виде двух изомеров:
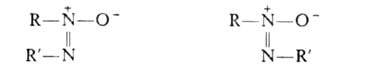
цис-Изомер транс-Изомер
циc-Изомеры менее устойчивы и при нагр. переходят в транс-форму.
Для несимметричных А. возможна изомерия положения: R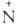 (O~)=NR'
и RN=
(O~)=NR'
и RN=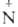 (O~)R'.
(O~)R'.
Хорошо изучены лишь ароматич. А.-обычно желтые кристаллы нейтрального характера. Простейший представитель-аз о к си бензол (R = R' = С6Н5): т. пл. 36 °С; d420 1,246; nD201,6644; раств. в спирте (17,5 г в 100 г при 16СС), эфире, лигроине.
В ИК-спектрах А. имеется сильная полоса валентных колебаний N—О при
частотах 1310-1250 см -1, в электронных спектрах алифатич. А.-полоса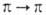 -перехода средней интенсивности в области 220 нм и малоинтенсивная полоса
п
-перехода средней интенсивности в области 220 нм и малоинтенсивная полоса
п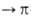 -перехода
в области 250-290 нм. Сопряжение с ароматич. кольцами сдвигает полосы поглощения
ароматич. А. в длинноволновую область, причем полосы и
-перехода
в области 250-290 нм. Сопряжение с ароматич. кольцами сдвигает полосы поглощения
ароматич. А. в длинноволновую область, причем полосы и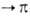 -переходов
обычно перекрываются более интенсивными полосами
-переходов
обычно перекрываются более интенсивными полосами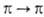 -переходов.
-переходов.
В мягких условиях, а также электрохимически А. восстанавливаются в азосоединения
RN—NR', в более жестких условиях [напр., действием (МН4)25]
- в гидразосоединения RHN—NHR' и далее с расщеплением связи N—N в первичные
амины RNH2 и R'NH2. А. способны к электроф. замещению,
напр.: С6Н5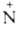 (O-)=NC6H5
+ Вr+
(O-)=NC6H5
+ Вr+ С6Н5
С6Н5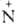 (O-)=NC6H4Br
+ H + . Электрофил вступает в ядро, связанное с атомом N, несущим
неподеленную пару
(O-)=NC6H4Br
+ H + . Электрофил вступает в ядро, связанное с атомом N, несущим
неподеленную пару
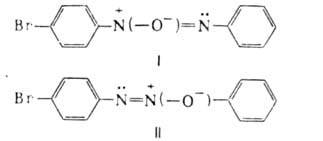
электронов. Поэтому, напр., изомер ф-лы I бромируется (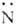 создает повыш. электронную плотность в ядре и свободно наиб. выгодное пара-положение),
а изомер ф-лы II-нет. При нагр. в кислой среде ароматич. А. претерпевают
термич. перегруппировку с образованием и-гидроксиазосоединений (перегруппировка
Валлаха): С6Н5
создает повыш. электронную плотность в ядре и свободно наиб. выгодное пара-положение),
а изомер ф-лы II-нет. При нагр. в кислой среде ароматич. А. претерпевают
термич. перегруппировку с образованием и-гидроксиазосоединений (перегруппировка
Валлаха): С6Н5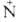 (—O-)=МС6Н5
(—O-)=МС6Н5 n-HOC6H4N=NC6H5, а при облучении
ртутной лампой-перегруппировку с образованием о-гидроксиазосоединений,
напр.:
n-HOC6H4N=NC6H5, а при облучении
ртутной лампой-перегруппировку с образованием о-гидроксиазосоединений,
напр.:
А. получают: окислением азосоединений в мягких условиях, напр, под действием
H2O2:RN=NR + [О] + R
+ R (—O~)=NR
(в случае несимметричных азосоединений образуется смесь изомеров положения);
восстановлением нитросоединений в щелочной среде действием CH3ONa,
As2O3 или др.:
(—O~)=NR
(в случае несимметричных азосоединений образуется смесь изомеров положения);
восстановлением нитросоединений в щелочной среде действием CH3ONa,
As2O3 или др.:
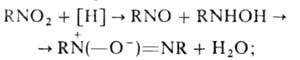
взаимод. нитрозосоединений с замещенными гидроксиламина по схеме предыдущего способа (в случае разл. R образуются изомеры положения).
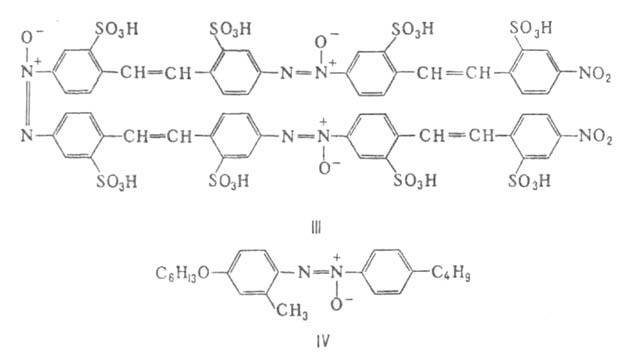
Нек-рые ароматич. А. применяют как красители, напр. прямой желтый К.
(ф-ла III), а также как активные компоненты жидких кристаллов, напр. соед.
ф-лы IV:
Лит.: Общая органическая химия, пер. с англ., т. 3, М., 1982,
с. 207 и посл. Б. И. Степанов.


