АЗОТА ОКСИДЫ. Гемиоксид N2O (оксид диазота, "веселящий
газ") имеет слабый приятный запах и сладковатый вкус (см. табл.). Молекула
линейна (длины связей в нм): Для N2O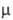 0,51 -10-30 Кл-м. Р-римость в воде (г на 100 г): 0,257 (0°С)
и 0,108 (25 °С); раств.
0,51 -10-30 Кл-м. Р-римость в воде (г на 100 г): 0,257 (0°С)
и 0,108 (25 °С); раств. в спирте, эфире, H2SO4. С водой, р-рами к-т и щелочей,
кислородом не взаимод. Выше 500°С с заметной скоростью разлагается на N2
и О2 и проявляет сильные окислит. св-ва (в N2O, как
и в О2, вспыхивает тлеющая лучина). Р-р H2SO3
восстанавливает N2O до N2, соли 8n2+ -
до NH2OH, соли Ti3+ -до NH3. С Н2,
NH3, CO, а также с орг. в-вами N2O образует взрывоопасные
смеси. Получают N2O разложением NH4NO3
при 250°С. Процесс экзотермичен и протекает с ускорением (при быстром нагревании
возможен взрыв).
в спирте, эфире, H2SO4. С водой, р-рами к-т и щелочей,
кислородом не взаимод. Выше 500°С с заметной скоростью разлагается на N2
и О2 и проявляет сильные окислит. св-ва (в N2O, как
и в О2, вспыхивает тлеющая лучина). Р-р H2SO3
восстанавливает N2O до N2, соли 8n2+ -
до NH2OH, соли Ti3+ -до NH3. С Н2,
NH3, CO, а также с орг. в-вами N2O образует взрывоопасные
смеси. Получают N2O разложением NH4NO3
при 250°С. Процесс экзотермичен и протекает с ускорением (при быстром нагревании
возможен взрыв).
СВОЙСТВА ОКСИДОВ АЗОТА
|
Показатель
|
N2O
|
NO
|
NOi
|
N2O4
|
N2O3
|
М;O5
|
|
Цвет
|
Бесцв
|
Бесцв.
|
Красно-бурый
|
Бесцв.
|
Голубой*
|
Бесцв.
|
|
Т. кип., °С
|
-88,5
|
-151,6
|
_
|
20,6
|
-40°С
|
33**
|
|
Т. пл., °С
|
-91,0
|
-163.7
|
—
|
-11,2
|
-101
|
41
|
|
Плотность газа, г/дм3
|
1.9778
|
1,3402
|
1,491 (0°С)
|
—
|
—
|
—
|
|
плотность жидкости
или твердого в-ва. |
1,226
|
1,332
|
1,536
|
2.05
|
||
|
г/см3 ......
|
(-88,5 °С)
|
(-163°С)
|
(-20°С)
|
(15°С)
|
||
|
tкрит- °С . . . . .
|
36,45
|
-93,0
|
—
|
158,2
|
—
|
—
|
|
pкрит МПа . . . .
|
7,254
|
6,48
|
—
|
10,13
|
—
|
—
|
|
Критич. объем.
дм3, /моль . . . |
0,0973
|
0.0580
|
_
|
0,167
|
_
|
_
|
|
С2. ДжДмоль*К) . .
|
38,63
|
29,86
|
37,18
|
79.2
|
72.7
|
45,3
|
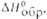 кДж, моль . .
кДж, моль . . |
81,6
|
91,26
|
34.2
|
11,1
|
86.6
|
1 3.3
|
|
S0298, Дж/(моль*К)
|
219,90
|
210,64
|
240,06
|
304,4
|
314,6
|
355,6
|
* Цвет кристаллов. ** Т-ра возгонки.
Монооксид NO парамагнитен и склонен к димериза-ции (жидкий NO содержит
25% димера, твердый целиком состоит из него). Длина связи N—О 0,115 нм,
энергия связи 626,84 кДж/моль;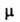 6,48 * 10- 30 Кл * м;
6,48 * 10- 30 Кл * м;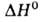 димеризации - 11,2 кДж/моль. Р-римость в воде (г на 100 г): 0,00988 (0°С)
и 0,00348 (100°С); раств. в спирте, CS2 и H2SO4.
димеризации - 11,2 кДж/моль. Р-римость в воде (г на 100 г): 0,00988 (0°С)
и 0,00348 (100°С); раств. в спирте, CS2 и H2SO4.
Ниже 1000°С NO практически не разлагается. Равновесные концентрации
NO, получающегося по р-ции N2 + + О, 2NO, составляют (в %): 0,61 (2000°С), 4,48 (3200°С), 10,00 (4200 °С) С
водой, разб. р-рами к-т и щелочей не взаимод. При обычных условиях быстро
окисляется до NO2, с повышением т-ры скорость р-ции уменьшается.
Это обусловлено тем, что с О2 взаимод. молекулы димера N2O2,
содержание к-рого с повышением т-ры уменьшается. Присоединяет галогены
с образованием нитрозилгалогени-дов NOHal. С H2SO4
в присут. воздуха дает нитрозилсер-ную к-ту (NO)HSO4. Восстанавливается
углеродом, фосфором, серой, SO2, H2, металлами до
N2, солями Сг2+ -до NH3 в нейтральной
среде и до NH2OH в кислой. Окисляется, напр. хроматами и перманганатами,
до HNO3. С солями мн. металлов образует нитрозокомплексы, напр.
нитропруссид Na2[Fe(NO) (CN)5]- важный аналит. реагент.
Образование комплексного соед. бурого цвета при взаимод. NO с FeSO4
в р-ре-качественная р-ция на NO:
2NO, составляют (в %): 0,61 (2000°С), 4,48 (3200°С), 10,00 (4200 °С) С
водой, разб. р-рами к-т и щелочей не взаимод. При обычных условиях быстро
окисляется до NO2, с повышением т-ры скорость р-ции уменьшается.
Это обусловлено тем, что с О2 взаимод. молекулы димера N2O2,
содержание к-рого с повышением т-ры уменьшается. Присоединяет галогены
с образованием нитрозилгалогени-дов NOHal. С H2SO4
в присут. воздуха дает нитрозилсер-ную к-ту (NO)HSO4. Восстанавливается
углеродом, фосфором, серой, SO2, H2, металлами до
N2, солями Сг2+ -до NH3 в нейтральной
среде и до NH2OH в кислой. Окисляется, напр. хроматами и перманганатами,
до HNO3. С солями мн. металлов образует нитрозокомплексы, напр.
нитропруссид Na2[Fe(NO) (CN)5]- важный аналит. реагент.
Образование комплексного соед. бурого цвета при взаимод. NO с FeSO4
в р-ре-качественная р-ция на NO:
[Fe(H20)6]S04 + NO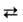 [Fe(H2O)5NO]SO4 + H2O
[Fe(H2O)5NO]SO4 + H2O
При нагр. р-ра идет обратная р-ция, и окраска исчезает. При действии NO на губчатое железо при высоком давлении образуется тетранитрозил Fe(NO)4. Известны нитрозилы Ru и Сr.
Монооксид получают каталитич. окислением NH3 как промежут. продукт в произ-ве азотной кислоты. Перспективен плазмохим. синтез. В лаб. NO получают взаимод. NaNO2 с H2SO4. В атмосфере он образуется при грозовых разрядах. Монооксид применяют также для получения NH2OH.
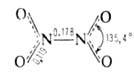
Сесквиоксид N2O3 (диазота триоксид) ниже — 101
°С существует как индивидуальное соединение. При более высоких т-рах находится
в равновесии с продуктами диссоциации NO и NO-,. Молекула плоская (длины
связей в нм).
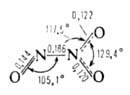
Для N2O3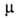 6,77*10-30Кл-м. Раств. в к-тах и эфире. С водой дает HNO2.
Образуется из NO и NO2 при охлаждении, по р-ции HN3
с As2O3, а также при пропускании электрич. искры
через жидкий воздух.
6,77*10-30Кл-м. Раств. в к-тах и эфире. С водой дает HNO2.
Образуется из NO и NO2 при охлаждении, по р-ции HN3
с As2O3, а также при пропускании электрич. искры
через жидкий воздух.
Диоксид NO2 парамагнитен; длина связи N—О 0,119 нм, угол
О—N—О 134°;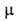 0,87*10
- 30 Кл-м. При отщеплении электрона (энергия ионизации ~ 942
кДж/моль) образуется нитроний-ион NO2 , при присоединении (сродство
к электрону — 228 кДж/моль)-нитрит-ион NO2.
0,87*10
- 30 Кл-м. При отщеплении электрона (энергия ионизации ~ 942
кДж/моль) образуется нитроний-ион NO2 , при присоединении (сродство
к электрону — 228 кДж/моль)-нитрит-ион NO2.
В обычных условиях NO 2 существует в равновесии с ди-мером-тетраоксидом
диазота N2O4 (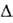 H°
димеризации - 57,3 кДж/моль). При нормальном давлении и 4047
H°
димеризации - 57,3 кДж/моль). При нормальном давлении и 4047
в такой смеси содержится 31% NO2, при 100°С-88% NO2, выше 140°С N2O4 целиком переходит в NO2. Жидкая смесь состоит в осн. из N2O4, а твердое в-во -чистый димер. Молекула димера диамагнитна, имеет плоскую структуру. Диоксид взаимод. с водой и р-рами щелочей:
2NO2 + H2O HNO3 + HNO2, 2NO2 + 2NaOH -> NaNO3
+ NaNO2 + H2O
HNO3 + HNO2, 2NO2 + 2NaOH -> NaNO3
+ NaNO2 + H2O
С соляной к-той образует NOC1, с серной - (NO)HSO4, с F2-нитрил
фторид NO2F. В смеси с CS2 взрывается. Восстанавливается
водородом в присут. Pt или Ni до NH3. Многие в-ва (С, S, Р,
орг. соед.) сгорают в NO2, так как NO2 и N2O4-сильные
окислители. Поскольку в жидком N2O4 существует равновесие:
N2O4 NO+ -I- NO3, нeк-рые металлы (напр., Zn, Си), реагируя
с жидким N2O4, образуют безводные нитраты:
NO+ -I- NO3, нeк-рые металлы (напр., Zn, Си), реагируя
с жидким N2O4, образуют безводные нитраты:
Zn + 2N2O4 -> Zn(NO3)2 + 2NO
Р-ры N2O4 в безводной HNO3-более сильные окислители, чем чистая HNO3.
Диоксид-промежут. продукт в произ-ве HNO3. В лаб. NO2 получают разложением безводного Pb(NO3)2 или взаимод. Си с конц. азотной к-той. Диоксид и N2O4-окислители в жидком ракетном топливе, смесевых ВВ, при очистке нефтепродуктов от сераорг. соед., катализаторы окисления орг. соед. (напр., бензола до фенола, метана до формальдегида).
Молекула газообразного оксида азота (V) N2O5 (пентаоксид
диазота) имеет неплоскую структуру (длины связей в нм):
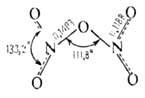
Кристаллич. _ N2O5-ионное соед. (NO2)+(NO3)-. При комнатной т-ре самопроизвольно разлагается на NO2 и О2, быстрое нагревание приводит к взрыву. Раств. в СНС13. С водой образует HNO3. В лаборатории N2O5 получают взаимод. HNO3 с Р2О5, жидкого NO2 или N2O3 с озонированным кислородом.
А. о. физиологически активны. Так, N2O - ср-во для наркоза, в высоких концентрациях вызывает удушье. Другие А. о. сильно ядовиты: NO действует на центральную нервную систему, в больших концентрациях превращает оксигемо-глобин в метгемоглобин; NO2 и N2O4 разрушающе действуют на легкие, в тяжелых случаях вызывают отек, понижают кровяное давление. При длительной работе в атмосфере, содержащей эти оксиды, развиваются разл. хронич. заболевания; ПДК NO2 9 мг/м3, остальных А. о.-5 мг/м3 (в пересчете на NO2).
Лит. см. при ст. Азот. Н. М. Жаворонков. И. К. Малина.


