АЛЮМИНИЙ (от лат. alumen, род. падеж aluminis - квасцы; лат. Aluminium) A1, хим. элемент III гр. периодич. системы, ат. н. 13, ат. м. 26,98154. В природе один стабильный изотоп 27А1. Поперечное сечение захвата тепловых нейтронов 215*10-25 м2. Конфигурация внеш. электронной оболочки 3s23p; степень окисления + 3, менее характерны + 1 и + 2 (только выше 800 °С в газовой фазе); энергия ионизации Аl0 -> А1+ -> А12 + -> А13+ соотв. 5,984, 18,828, 28,44 эВ; сродство к электрону 0,5 эВ; электроотрицательность по Полингу 1,5; атомный радиус 0,143 нм, ионный радиус А13+ (в скобках указаны координац. числа) 0,053 нм (4), 0,062 нм (5), 0,067 нм (6).
Содержание А. в земной коре 8,8% по массе. По распространенности в природе занимает четвертое место среди всех элементов (после О, Н и Si) и первое среди металлов; в своб. виде не встречается. Важнейшие минералы: боксит, представляющий собой смесь гидроксидов А. - диаспора и бемита А1ООН и гиббсита (гидраргиллита) А1(ОH)3 (крупнейшие месторождения в Австралии, Бразилии, Гвинее и на Ямайке; пром. месторождения имеются также в СФРЮ, Греции, ВНР, Франции и СССР); алунит, или квасцовый камень (Na, К)2 * SO4*A12(SO4)3*4A1(OH3) (осн. месторождения в СССР, ЧССР, Италии); нефелин (Na,K)2O*Al2O3*2SiO2 (осн. месторождения в СССР, Гренландии, Норвегии, Швеции, Кении).
Свойства. А. - серебристо-белый легкий металл; кристаллич. решетка
кубич. гранецентрированная (а = 0,40403 нм, z = 4, пространств.
группа Fт3т). Т. пл. 660 °С, т. кип. ок. 2452°С; плотн. А. 99,996%-ной
чистоты 2,6989 (20°С) и 2,289 (1000°С) г/см3; Сp°
24,35 Дж/(моль*К);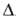 Н0пл10,9
кДж/моль,
Н0пл10,9
кДж/моль,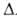 Н0исп
302,13 кДж/моль; S0298 28 Дж/(моль*К); давление пара
(Па) 0,266 (660°С), 13,3 (1123°С), 133 (1279°С); температурный коэф. линейного
расширения 24,58*10 -6 К-1 (20-200°С); теплопроводность
1,24*10-3 Вт/(м*К);
Н0исп
302,13 кДж/моль; S0298 28 Дж/(моль*К); давление пара
(Па) 0,266 (660°С), 13,3 (1123°С), 133 (1279°С); температурный коэф. линейного
расширения 24,58*10 -6 К-1 (20-200°С); теплопроводность
1,24*10-3 Вт/(м*К);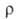 0,0265 мкОм*м; для А. 99,85%-ной чистоты
0,0265 мкОм*м; для А. 99,85%-ной чистоты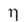 (Н*с/м2) 2*10-3 (800°С), 1,5*10-3 (900°С),
1,3*10-3 (1000°С);
(Н*с/м2) 2*10-3 (800°С), 1,5*10-3 (900°С),
1,3*10-3 (1000°С);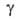 (на
границе с Аг) 0,86 Н/м (700-750 °С). А. слабо парамагнитен. Стандартный
электродный потенциал А13+/А1° -1,663В в кислой среде и -2,35
В в щелочной. Модуль упругости 7*103МПа; для отожженного металла
твердость по Бринеллю 170 МПа, для холоднокатаного 270 МПа,
(на
границе с Аг) 0,86 Н/м (700-750 °С). А. слабо парамагнитен. Стандартный
электродный потенциал А13+/А1° -1,663В в кислой среде и -2,35
В в щелочной. Модуль упругости 7*103МПа; для отожженного металла
твердость по Бринеллю 170 МПа, для холоднокатаного 270 МПа,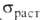 соотв. 50 и 115 МПа, относит. удлинение 49 и 5,5%. При охлаждении ниже
120 К прочностные св-ва А. в отличие от большинства металлов возрастают,
а пластические не изменяются.
соотв. 50 и 115 МПа, относит. удлинение 49 и 5,5%. При охлаждении ниже
120 К прочностные св-ва А. в отличие от большинства металлов возрастают,
а пластические не изменяются.
На воздухе А. покрывается тонкой прочной беспористой пленкой А12О3, защищающей металл от дальнейшего окисления и обусловливающей его высокую коррозионную стойкость. По этой же причине А. не реагирует с конц. HNO3. Техн. А. легко взаимод. с разбавленными соляной к-той H2SO4 и HNO3, образуя соли. А. легко реагирует со щелочами, давая алюминаты.
При 25 °С А. образует с хлором, бромом и иодом соотв. алюминия хлорид
А1С13,
бромид А1Вr3 и иодид АlI3, при 600°С с фтором-алюминия
фторид A1F3. Бромид -бесцв. расплывающиеся на воздухе кристаллы;
т. пл. 97 °С, т. кип. 255°С; H°обр-514
кДж/моль; раств. в воде, спирте, CS2, ацетоне. Иодид-светло-коричневые
расплывающиеся на воздухе кристаллы; т. пл. 180°С, т. кип. 360°С;
H°обр-514
кДж/моль; раств. в воде, спирте, CS2, ацетоне. Иодид-светло-коричневые
расплывающиеся на воздухе кристаллы; т. пл. 180°С, т. кип. 360°С;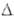 H°обр-309 кДж/моль; раств. в воде, спирте, эфире, CS2.
H°обр-309 кДж/моль; раств. в воде, спирте, эфире, CS2.
Порошкообразный А. выше 800°С образует с азотом алюминия нитрид A1N. При взаимод. атомарного Н с парами А. при -196 °С получается гидрид (А1Н)Х (х = 1, 2), стабильный до — 76°С; (А1Н3)Х, синтезированный взаимод. А1С13 с Li[А1Н4],-бесцв. аморфный порошок, разлагается на элементы выше 100°С, водой гидролизуется. А. реагирует с S выше 200°С, давая сульфид A12S3-бесцв. кристаллы; т. пл. 1120°С, т. возг. 1550°С (в токе N2);
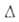 H°обр
-723 кДж/моль; разлагается водой, к-тами. С фосфором при 500°С А. образует
фосфид А1Р-желтовато-серые кристаллы, устойчивые до 1000°С;
H°обр
-723 кДж/моль; разлагается водой, к-тами. С фосфором при 500°С А. образует
фосфид А1Р-желтовато-серые кристаллы, устойчивые до 1000°С; H°обр
—
121 кДж/моль; разлагается к-тами и щелочами. При взаимод. расплавленного
А. с В образуются бориды А1В2 и А1В12-желто-серые
или коричневые кристаллы; т. пл. 2200 °С; не разлагаются водой и к-тами.
H°обр
—
121 кДж/моль; разлагается к-тами и щелочами. При взаимод. расплавленного
А. с В образуются бориды А1В2 и А1В12-желто-серые
или коричневые кристаллы; т. пл. 2200 °С; не разлагаются водой и к-тами.
Выше 800°С могут образовываться соед. А1(I), напр.: А12Х3
+ 4А1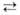 ЗА12Х (X = О, S, Se).
ЗА12Х (X = О, S, Se).
С рядом металлов и неметаллов А. образует сплавы (см. Алюминия сплавы), в к-рых содержатся интерметаллич. соед. - алюминиды, обычно весьма тугоплавкие (как правило, т. пл. выше 1000°С) и обладающие высокой твердостью (напр., твердость по Бринеллю для СuА12 и СгА17 ок. 5000 МПа, для TiAl3 ок. 7000 МПа, для РеА13 ок. 10000 МПа) и жаропрочностью. Алюминиды выполняют роль модификаторов сплавов и придают изделиям высокие мех. св-ва.
Получение и переработка. А. получают электролизом р-ра глинозема (техн. А12О3) в расплавленном криолите Na3[AlF6] (см. Алюминия фторид)при 960-970°С. Состав электролита: 75-90% по массе Na3 [A1F6], 5-12% A1F3, 2-10% CaF2, 1-10% A12O3; молярное отношение NaF: A1F3 = 2,20-2,85. Пром. комплекс по получению А. включает произ-во глинозема из алюминиевых руд (см. об этом Алюминия оксид), криолита и др. фторидов, углеродистых анодных и футеровочных материалов и собственно электролитич. получение А.
Электролиз глинозема ведут в аппаратах, катодом в к-рых служит подина
ванны, анодом - предварительно обожженные угольные блоки или самообжигающиеся
электроды, погруженные в расплавленный электролит. В расплаве протекают
след. р-ции:
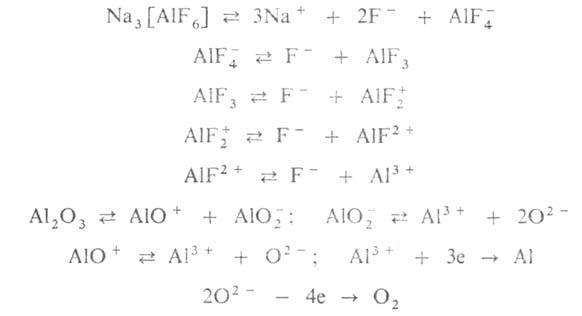
Жидкий А. накапливается на подине ванны, на аноде выделяется О2, образующий с его материалом СО и СО2. Плотность тока на аноде 0,7-0,9 А/см2, на катоде 0,4-0,5 А/см2; для разл. типов электролизеров сила тока составляет 100-250 кА, рабочее напряжение 4.2-4,5 В (поддерживается автоматически); на получение 1 т чернового А. расходуется 14-16 тыс. кВт*ч электроэнергии, 1,92-1,95 т А12О3, 0,5-0,6 т анодного материала; суточная производительность ванны средней мощности от 550 до 1200 кг. А. отбирают из электролизера один раз в 1-2 сут.
А. высокой чистоты (не более 0,05% примесей) получают электролитич.
рафинированием чернового А., содержащего до 1% примесей; в кач-ве электролита
чаще всего используют расплав Na3[A1F6], ВаС12
(до 60%) и NaCl (до 4%). Для получения А. особой чистоты (не более 0,001%
примесей) применяют зонную плавку или хим. транспортную р-цию: 2А1 (жидкость)
+ А1F3(газ)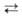 3А1F(газ).
3А1F(газ).
А. разливают в чушки или плоские слитки, к-рые затем перерабатывают в листы, фольгу, профили, проволоку. Он хорошо сваривается, поддается ковке, штамповке, прокатке, волочению и прессованию, а также обрабатывается методами порошковой металлургии. А. в виде порошка производят распылением струи жидкого чистого А. упругой струей смеси N2 и О2 (2-8%). Частицы порошка при этом покрываются пленкой А12О3, содержание к-рого колеблется от 6 до 17%. При содержании О2 в газовой струе менее 2% порошок самопроизвольно возгорается на воздухе, при содержании О2 более 8%-горит при распылении. Сухим и мокрым размолом порошка в шаровых мельницах получают А. соотв. в виде пудры и пасты.
Порошок А. со средним размером частиц до 20 мкм пирофорен; т. самовоспл. 490°С, т. воспл. 420°С; ниж. КПВ 0,025-0,045 кг/м3. Аэрозоль А. в воздухе воспламеняется при 645°С.
Определение. А. обнаруживают по образованию окрашенных соед. с ализарином, алюминоном, морином или с помощью эмиссионного спектрального анализа. Гравиметрич. методы определения основаны на выделении А. в виде гидроксида, бензоата, гидроксихинолината и послед. прокаливании их при 1200°С до А12О3, к-рый взвешивают. При титриметрич. определении А. при рН 4,5 связывают в комплекс динатриевой солью этилендиаминтетрауксусной к-ты, избыток к-рой оттитровывают р-ром соли Zn. Для количеств. определения А. используют также фотометрич. (с помощью 8-гидроксихинолина, алюминона, эриохромцианина, хромазурола S) и атомно-абсорбционный (с использованием резонансного излучения с длиной волны 309,3 нм) методы анализа.
Применение. А. используют гл. обр. для получения алюминиевых сплавов. Чистый А-конструкц. материал в стр-ве жилых и обществ. зданий, с.-х. объектов, в судостроении, для оборудования силовых подстанций и др. Применяют А. также для изготовления кабельных, токопроводящих и др. изделий в электротехнике, корпусов и охладителей диодов, спец. хим. аппаратуры, товаров народного потребления и др. Покрытия из А. наносят на стальные изделия для повышения их коррозионной стойкости. Способы нанесения: распыление (для защиты стальных конструкций, эксплуатирующихся в приморских зонах, на хим. предприятиях и др.); погружение в расплав (для получения алюминированных стальных лент); плакирование прокаткой (биметаллич. ленты); вакуумное напыление (для алюминирования лент из стали, тканей, бумаги и пластмасс, инструментальных зеркал и др.); электрохим. способ (для получения материалов и изделий с защитно-декоративными св-вами).
А. - в виде порошка и гранул - раскислитель чугуна и стали, восстановитель оксидов при получении металлов (напр., Сr, Мn, Са) и сплавов (напр., ферромолибдена, феррониобия, ферровольфрама) методом алюминотермии, компонент твердых ракетных топлив, пиротехн. составов, ВВ. Алюминиевая пудра и паста - пигменты лакокрасочных материалов; пудра используется также как газообразователь в произ-ве ячеистых бетонов.
По объему произ-ва А. занимает среди металлов второе место после стали (в развитых капиталистич. странах - 12 млн т в 1980). В стр-ве и транспортном машиностроении расходуется приблизительно по 24% чистого А. и его сплавов, в произ-ве упаковочных материалов и консервных банок - ок. 17%, в электротехнике - ок. 10%, в произ-ве потребительских товаров-ок. 8%.
Металлич. А. впервые получен в 1825 X. К. Эрстедом.
Лит.: Беляев А. И., Металлургия легких металлов, 6 изд., М.,
1970; Aluminium-Taschenbuch, 13 Aufl., Diisseldorf, 1974. А.Ф.Белов.


