АЛЮМИНИЯ ФТОРИД A1F3, бесцв. кристаллы. При обычных
условиях устойчива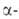 модификация
с тригон. решеткой (а = 0,5039 нм,
модификация
с тригон. решеткой (а = 0,5039 нм,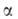 58,50°,
z = 2, пространств. группа R32); плотн. 1,882 г/см3. Известна
также устойчивая до 710-720°С
58,50°,
z = 2, пространств. группа R32); плотн. 1,882 г/см3. Известна
также устойчивая до 710-720°С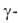 модификация
с тетрагон. решеткой (а = = 0,354 нм, с = 0,600нм). Т. возг. 1270°С;
С°р 75,10 ДжДмоль*К);
модификация
с тетрагон. решеткой (а = = 0,354 нм, с = 0,600нм). Т. возг. 1270°С;
С°р 75,10 ДжДмоль*К);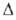 H0возг
272 кДж/моль,
H0возг
272 кДж/моль,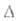 H°обр
-1510 кДж/моль; S0298 66,48 ДжДмоль*К); ур-ния
температурной зависимости давления пара: Igp(Пa) = 16,565 - 16967/Т (980
H°обр
-1510 кДж/моль; S0298 66,48 ДжДмоль*К); ур-ния
температурной зависимости давления пара: Igp(Пa) = 16,565 - 16967/Т (980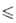 Т
Т 1123
К), lg р (Па) = 14,719- 14974/Т (1027
1123
К), lg р (Па) = 14,719- 14974/Т (1027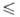 Т
Т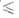 1184
К).
1184
К).
А. ф. плохо раств. в воде (0,41% по массе при 25°С), лучше - в р-рах HF, не раств. в орг. р-рителях. Образует кристаллогидраты с 1, 3 и 9 молекулами воды. При нагр. гидролизуется парами воды, медленно взаимод. с конц. H2SO4, разлагается р-рами и расплавами щелочей.
Получают А. ф.: взаимод. А12О3 или А1(ОН)3
с р-ром HF с послед. выделением, сушкой и прокаливанием при 500-600°С образовавшегося
A1F3-3H2O; действием на А12О3
газообразного HF при 450-600 °С; по р-ции 2А1(ОН)3 + H2SiF6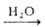 2A1F3*ЗН2О + SiO2*nН2О с послед.
выделением, сушкой и прокаливанием гидрата; взаимодействие А1(ОН)3
с р-ром NH4F или безводным NH4HF2 с последующим
разложением образовавшегося (NH4)3 [A1F6]
при 450-550°С
2A1F3*ЗН2О + SiO2*nН2О с послед.
выделением, сушкой и прокаливанием гидрата; взаимодействие А1(ОН)3
с р-ром NH4F или безводным NH4HF2 с последующим
разложением образовавшегося (NH4)3 [A1F6]
при 450-550°С
А. ф. - компонент электролита (5-7%) в произ-ве А1; входит в состав флюсов, эмалей, стекол, глазурей, керамики, покрытий сварочных электродов; катализатор в орг. синтезе. Обратимую р-цию A1F3 с А1 используют для очистки металла.
Известны гидратированные оксифториды А1, напр. A12OF4*3,5H2O, гидроксифториды и существующий только в газовой фазе монофторид A1F. С фторидами щелочных металлов A1F3 образует фтороалюминаты.
Гексафтороалюминат натрия Na3[AlF6] - бесцв. кристаллы;
т. пл. 1011 °С (с разл.); плотн. низкотемпературной модификации
(криолита) 2,97 г/см3; С°р 216 ДжДмоль*К);
модификации
(криолита) 2,97 г/см3; С°р 216 ДжДмоль*К); Н°обр
-3312 кДж/моль,
Н°обр
-3312 кДж/моль, G°обр
-3148 кДж/моль; S0298 238 Дж/(моль*К); плохо раств.
в воде (0,42% по массе при 25°С) и орг. р-рителях; взаимод. с конц. H2SO4;
при нагр. гидролизуется парами воды. Расплав Na3 [A1F6]
электропроводен и является хорошим р-рителем для А12О3
и др. оксидов. Криолит получают: действием Na2CO3
или NaF на р-р А1(ОН)3 или А12О3 в HF;
взаимод. водных р-ров A1F3 и NaF; взаимод. А1(ОН)3
и Na2CO3 или NaAlO2 с водным р-ром NH4F.
Криолит- редкий в природе минерал; осн. компонент (80-85%) электролита
в произ-ве А1; металлургич. флюс; компонент стекол и эмалей; наполнитель
резин.
G°обр
-3148 кДж/моль; S0298 238 Дж/(моль*К); плохо раств.
в воде (0,42% по массе при 25°С) и орг. р-рителях; взаимод. с конц. H2SO4;
при нагр. гидролизуется парами воды. Расплав Na3 [A1F6]
электропроводен и является хорошим р-рителем для А12О3
и др. оксидов. Криолит получают: действием Na2CO3
или NaF на р-р А1(ОН)3 или А12О3 в HF;
взаимод. водных р-ров A1F3 и NaF; взаимод. А1(ОН)3
и Na2CO3 или NaAlO2 с водным р-ром NH4F.
Криолит- редкий в природе минерал; осн. компонент (80-85%) электролита
в произ-ве А1; металлургич. флюс; компонент стекол и эмалей; наполнитель
резин.
Гексафтороалюминат аммония (NH4)3 [A1F6]
бесцв. кристаллы; плотн. 1,837 г/см3 (20°С); Н°обр
-3060 кДж/моль; при нагр. разлагается последовательно до NH4[A1F4]
и A1F3; раств. в воде (7,66% по массе при 25°С), не раств. в
орг. р-рителях. Получают взаимод. А1(ОН)3 и А12О3
с NH4F или NH4HF2. Промежут. продукт в
произ-ве A1F3.
Н°обр
-3060 кДж/моль; при нагр. разлагается последовательно до NH4[A1F4]
и A1F3; раств. в воде (7,66% по массе при 25°С), не раств. в
орг. р-рителях. Получают взаимод. А1(ОН)3 и А12О3
с NH4F или NH4HF2. Промежут. продукт в
произ-ве A1F3.
Лит.: Пустильник Г. Л., Вольфсон Г. И., Галков А. С, Производство
фтористых солей для алюминиевой промышленности за рубежом, М., 1976.
Э. Г. Раков.


