АМИНОНАФТОЛЫ C10H6(NH2)OH, мол. м. 159,19; бесцв. кристаллы (см. табл.); практически не раств. в воде, раств. в спирте, эфире, бензоле.
ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ (°С) АМИНОНАФТОЛОВ, ИХ N-АЦЕТИЛ-И N-БЕНЗОИЛПРОИЗВОДНЫХ

А. амфотерны: реагируя с минер. к-тами, образуют нафтоламмониевые соли, с едкими щелочами-нафтоляты. Окисляются на воздухе, особенно легко в щелочных р-рах, причем р-ры окрашиваются. А., содержащие группы ОН и NH2 в одном кольце, при окислении превращ. в нафтохиноны. А., у к-рых группы NH2 и ОН находятся в разных кольцах, могут вступать с солями диазония в азосочетание; при этом в кислой среде проявляется ориентирующее влияние аминогруппы, в щелочной-гидроксильной. Азосочетанием сначала в кислой среде, а затем в щелочной получают дисазосоединения. При взаимод. с ангидридами или хлорангидридами карболовых к-т А. превращаются в N-ациламинонафтолы, обладающие четкими т-рами плавления, что используют для идентификации А.
В пром-сти получают 1,5-А. (пурпурол), 1,7- и 1,8-А. сплавлением соответствующих
нафтиламиносульфокислот со щелочами при 250 °С. А. можно синтезировать
также след. методами: восстановлением (SnCl2 и НС1) нитропроизводных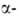 и
и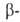 нафтолов;
нагреванием аминонафтолсульфокислот с минер. к-той выше 100°С; нагреванием
дигидроксинафталина с конц. р-ром NH3 при 180°С; кипячением
нафтилендиамина с водным р-ром NaHSO3; взаимод.
нафтолов;
нагреванием аминонафтолсульфокислот с минер. к-той выше 100°С; нагреванием
дигидроксинафталина с конц. р-ром NH3 при 180°С; кипячением
нафтилендиамина с водным р-ром NaHSO3; взаимод.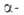 и
и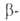 нафтолов
с NaNH2 при 230 °С. 1,5-, 1,7- и 1,8-А.-промежут. продукты в
произ-ве сернистых красителей и азокрасителей. Большое значение в произ-ве
азокрасителей имеют сульфокислоты А. (см. Аминонафпюлсульфокислоты).
нафтолов
с NaNH2 при 230 °С. 1,5-, 1,7- и 1,8-А.-промежут. продукты в
произ-ве сернистых красителей и азокрасителей. Большое значение в произ-ве
азокрасителей имеют сульфокислоты А. (см. Аминонафпюлсульфокислоты).
Лит.: Доналдсон Н., Химия и технология соединений нафталинового
ряда, пер. с англ, М, 1963; Эфрос Л. С, Горелик М. В., Химия и технология
промежуточных продуктов, Л., 1980. Г. И. Пуца.


