АНГИДРИДЫ НЕОРГАНИЧЕСКИХ КИСЛОТ, оксиды, при взаимод. к-рых с водой образуются к-ты, напр.: SO3 + Н2О -> H2SO4. Оксиды, дающие при р-ции с водой две к-ты (напр., 2NO2 + Н2О -> HNO3 + HNO2), рассматривают как ангидриды обеих к-т. Назв. ангидридов (А.) производят от назв. соответствующих к-т, напр. SO2 - сернистый, N2O5 - азотный А. Однако термин "ангидрид" выходит из употребления; для обозначения А. используют номенклатуру, принятую для любых оксидов элементов.
А. - твердые в-ва (В2О3, Р2О5 и др.), жидкости (SO3, Мn2О7 и др.) или газы (С12О, SO2 и др.). Многие из них мож-
но получить дегидратацией соответствующих к-т при нагр. или действии
сильных поглотителей влаги, напр.:
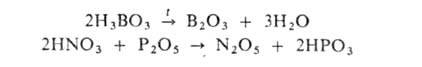
А.-весьма реакционноспособные соединения. С водой обычно реагируют быстро. Интенсивно взаимод. с основными оксидами и основаниями с образованием солей. Многие А. (СrO3, Мn2О7, С12О и др.)-сильные окислители. Ряд А. имеет важное практич. значение. См., напр., Азота оксиды, Бора оксиды, Фосфора оксиды, Хлора оксиды. С. И. Дракин.


