АЦЕТИЛАЦЕТОН (2,4-пентандион, диацетилметан), мол. м. 100,12; бесцветная жидкость с запахом ацетона и уксусной кислоты. Для А. характерна кето-енольная таутомерия:
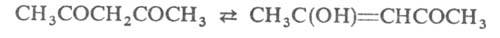
(в зависимости от р-рителя содержит 19-92% енольной формы). Кетонная
форма имеет т. пл. -23°С, т. кип. 139-140°С, 60°С/20 мм рт. ст.; d420
0,9721, nD20 1,4513; H°сгор
-2996кДж/моль;
H°сгор
-2996кДж/моль;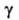 3,2*10-4Н/см (11°С);
3,2*10-4Н/см (11°С);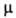 9,99*10-30 Кл*м. Для енольной формы т. пл. — 9°С; nD20
1,4609. А. смешивается со всеми орг. р-рителями. Р-римость в воде (г
в 100 г): 15 (30°С) и 34 (80°С). С этилбензолом дает азеотроп (т. кип.
135°С; 40% А.). А. - одноосновная к-та; рКа 8,95 (20°С).
9,99*10-30 Кл*м. Для енольной формы т. пл. — 9°С; nD20
1,4609. А. смешивается со всеми орг. р-рителями. Р-римость в воде (г
в 100 г): 15 (30°С) и 34 (80°С). С этилбензолом дает азеотроп (т. кип.
135°С; 40% А.). А. - одноосновная к-та; рКа 8,95 (20°С).
При взаимод. со щелочами А. образует производные, к-рые легко алкилируются
алкилиодидами, напр.:
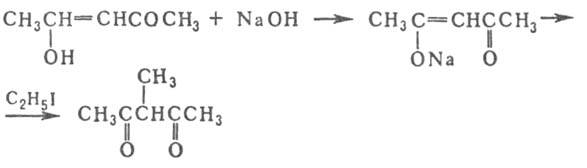
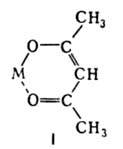
Енольная форма с катионами щелочных и щел.-зем. металлов, РЗЭ и др. образует ацетилацетонаты, напр. ф-лы I. При нагр. с КОН А. расщепляется на ацетон и уксусную к-ту. В присут. платиновой черни в орг. р-рителях восстанавливается до 2,4-пентандиола и 2-пентанола. При окислении озоном при — 20 °С в СС14 образуется озонид, расщепляющийся на метилглиоксаль и СО2. Действие NO при -15°С дает 2,3,4-пентантрион, электролиз Na-производного-тетраацетилэтан, с n-нитрофенилги-дразином при комнатной т-ре в воде-1-(n-нитрофенил)-3,5-диметилпиразол, при обработке NaN3 и H2SO4 -2,5-диметилоксазол.
А. получают взаимод. ацетона с уксусным ангидридом в присут. BF3
(выход 80-85%) либо с этилацетатом в присут. C2H5ONa
или амидов Na и Li (выход 40%). Применяют в аналит. химии при экстракц.
разделении мн. элементов, напр. AI, Со, Си, Fe(III), Mo, Mn, Pb, Ti, спектрофотометрич.
определении Be, гравиметрич. определении Se и Zr, при анализе неорг. в-в
методом жидкостной хроматографии.
Лит.: Синтезы органических препаратов, пер. с англ., т. 3, М.,
1952, с. 92-96; Общая органическая химия, пер. с англ., т. 2, М., 1981
с. 631-34: Chemistry of carbon compounds, ed. by E.H. Rodd, v. 1, Amst.,
1951. И.В. Хвостов.


