БУХНЕРА - КУРЦИУСА - ШЛОТТЕРБЕКА РЕАКЦИЯ,
получение карбонильных соед. и замещенного оксирана взаимод. альдегида или
кетона с диазосоединением, напр.:
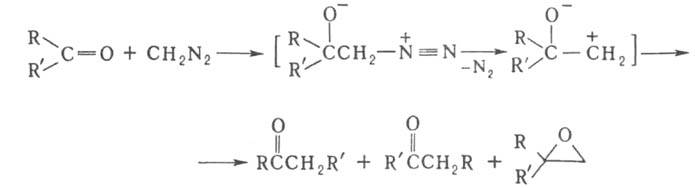
Процесс обычно осуществляют при комнатной или более низкой т-ре в эфире,
иногда с применением катализаторов, напр. Н2О, спиртов, LiCl.
В качестве диазосоединений обычно используют диазометан, диазоуксусный
эфир и этиловый эфир диазокротоновой
к-ты. В нек-рых случаях диазосоединение получают в ходе р-ции из нитрозоалкилуретанов
ROC(O)N(NO)(R') в присут. основания в среде метанола.
диазокротоновой
к-ты. В нек-рых случаях диазосоединение получают в ходе р-ции из нитрозоалкилуретанов
ROC(O)N(NO)(R') в присут. основания в среде метанола.
Направление р-ции зависит от строения карбонильного соединения. Обычно
образуется смесь трех продуктов. Электроноакцепторные заместители в положении
к карбонильной группе ускоряют р-цию и повышают выход замещенного оксирана,
электронодонорные - карбонильных соединений. Ациклич. кетоны реагируют
медленнее альдегидов и, кроме того, приводят к большему выходу оксиранов.
положении
к карбонильной группе ускоряют р-цию и повышают выход замещенного оксирана,
электронодонорные - карбонильных соединений. Ациклич. кетоны реагируют
медленнее альдегидов и, кроме того, приводят к большему выходу оксиранов.
В случае алициклич. кетонов основная р-ция - расширение цикла, напр.:
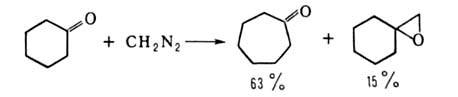
При использовании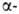 метил-
и
метил-
и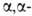 диметилциклопентанонов
и циклогексанонов выход кетона достигает 96%.
диметилциклопентанонов
и циклогексанонов выход кетона достигает 96%.
При использовании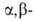 непредельных
альдегидов или кетонов диазосоединение присоединяется по кратной связи
с образованием замещенного 1-пиразолина:
непредельных
альдегидов или кетонов диазосоединение присоединяется по кратной связи
с образованием замещенного 1-пиразолина:
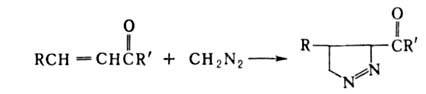
В случае 1,2-дикарбонильных соед. образуется циклич. диэфир, напр.:
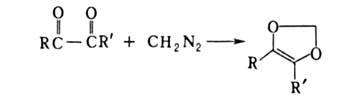
Побочные процессы в р-ции - полимеризация диазосоединения и его взаимод. с образующимися карбонильными соединениями.
Р-ция открыта Э. Бухнером и Т. Курциусом в 1885, позднее подробно изучалась Ф. Шлоттербеком.
Лит.: Гутше К., в сб.: Органические реакции, пер. с англ., сб.
8, М., 1956, с. 469-559. Н.Э. Нифантьев.


