ВАНАДИЯ ГАЛОГЕНИДЫ. Известны дигалогениды VHal2, тригалогениды VHal3, тетрагалогениды VHal4 (Hal = F, Cl, Вr), пентагалогениды VHal5 (Hal = F) и оксогалогениды VOHal (Hal = F, Cl), VOHal2, VOHal3 (Hal = F, Cl, Br) и VO2Hal (Hal = F, Cl).
Пентафторид VР5 - бесцв. кристаллы с орторомбич. решеткой
(а = 0,540 нм, b=1,672 нм, с = 0,753 нм, z = 8, пространств.
группа Ртсп)т. пл. 19,5°С, т. кип. 48,3°С;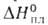 4,2 кДж/моль,
4,2 кДж/моль,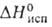 44,6 кДж/моль, для жидкого
44,6 кДж/моль, для жидкого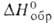 — 1480 кДж/моль; гидролизуется водой; образует комплексные фториды, напр.
М [VF6] (М = Li, Na, Ag и др.); легко восстанавливается до V(IV).
Получают взаимод. V и F2 при 300°С. Тетрафторид VF4 -
зеленые кристаллы; гидролизуется водой; сильно гигроскопичен. Получают
взаимод. VC14 и HF при 150°С VF4 и VOF2 образуют
комплексные фториды соотв. М2[VF6] и M2[VOF4]*H2O.
Трифторид VF3 - зеленые кристаллы; т. пл. 1410oС;
не раств. в воде. Получают взаимод. V2O3, VC13
с газообразным HF. Компонент катодов в хим. источниках тока.
— 1480 кДж/моль; гидролизуется водой; образует комплексные фториды, напр.
М [VF6] (М = Li, Na, Ag и др.); легко восстанавливается до V(IV).
Получают взаимод. V и F2 при 300°С. Тетрафторид VF4 -
зеленые кристаллы; гидролизуется водой; сильно гигроскопичен. Получают
взаимод. VC14 и HF при 150°С VF4 и VOF2 образуют
комплексные фториды соотв. М2[VF6] и M2[VOF4]*H2O.
Трифторид VF3 - зеленые кристаллы; т. пл. 1410oС;
не раств. в воде. Получают взаимод. V2O3, VC13
с газообразным HF. Компонент катодов в хим. источниках тока.
Тетрахлорид VC14 - красно-бурая жидкость; т. пл. -20,5°С,
т. кип. 152°С;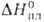 9,6 кДж/моль,
9,6 кДж/моль,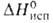 41,4 кДж/моль,
41,4 кДж/моль,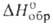 —606,1 кДж/моль; гидролизуется водой; образует аддукты с аминами, арсинами,
гетероциклич. соединениями. Получают взаимод. V или феррованадия с С12
при 200-300 °С. Промежут. продукт при получении чистого V восстановлением
водородом, Na или Mg; хлорирующий агент орг. соед., напр. ароматич. и алифатич.
непредельных углеводородов.
—606,1 кДж/моль; гидролизуется водой; образует аддукты с аминами, арсинами,
гетероциклич. соединениями. Получают взаимод. V или феррованадия с С12
при 200-300 °С. Промежут. продукт при получении чистого V восстановлением
водородом, Na или Mg; хлорирующий агент орг. соед., напр. ароматич. и алифатич.
непредельных углеводородов.
Трихлорид VC14 - красно-фиолетовые кристаллы; т. возг. выше
425 °С;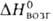 186,8 кДж/моль,
186,8 кДж/моль,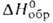 -597,7 кДж/моль; раств. в воде, из водных р-ров кристаллизуется гексагидрат;
диспропорционирует на VC14 и VC12 ; образует аддукты
с нитрилами, спиртами, эфирами, аминами. Получают термич. разложением VC14
при кипении на свету. Промежут. продукт при получении чистого V восстановлением
Mg или Na. Дихлорид VC12 - светло-зеленые кристаллы; т. возг.
выше 1000°С. Оксотрихлорид VOC13 - жидкость желтого цвета; т.
пл. — 79°С, т. кип. 127°С;
-597,7 кДж/моль; раств. в воде, из водных р-ров кристаллизуется гексагидрат;
диспропорционирует на VC14 и VC12 ; образует аддукты
с нитрилами, спиртами, эфирами, аминами. Получают термич. разложением VC14
при кипении на свету. Промежут. продукт при получении чистого V восстановлением
Mg или Na. Дихлорид VC12 - светло-зеленые кристаллы; т. возг.
выше 1000°С. Оксотрихлорид VOC13 - жидкость желтого цвета; т.
пл. — 79°С, т. кип. 127°С;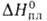 9,6 кДж/моль,
9,6 кДж/моль,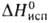 36,4 кДж/моль,
36,4 кДж/моль,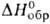 — 740,7 кДж/моль; образует аддукты со спиртами, диоксаном, РОС13,
нитрилами. Применяют как катализатор полимеризации олефинов, а также в
полупроводниковой технике для получения эпитаксиальных пленок VO2.
— 740,7 кДж/моль; образует аддукты со спиртами, диоксаном, РОС13,
нитрилами. Применяют как катализатор полимеризации олефинов, а также в
полупроводниковой технике для получения эпитаксиальных пленок VO2.
Трииодид VI3 и трибромид VBr3 близки по св-вам
к VC13, но менее устойчивы. VI3 - темно-коричневые
кристаллы; при 300°С разлагается на VI2 и I2;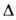 Hoобр
—280 кДж/моль; получают взаимод. V и I2 при 120-300°С. VBr3
- черные кристаллы;
Hoобр
—280 кДж/моль; получают взаимод. V и I2 при 120-300°С. VBr3
- черные кристаллы;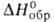 —459,8 кДж/моль. Дииодид VI2 - темно-фиолетовые кристаллы; при
1400°С диссоциирует на V и I2 ;
—459,8 кДж/моль. Дииодид VI2 - темно-фиолетовые кристаллы; при
1400°С диссоциирует на V и I2 ;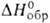 — 263,3 кДж/моль; ур-ние температурной зависимости давления пара при 850-1016
°С: Igp(aT) = 2,56-5600/Т. Иодиды V-промежут. продукты при его иодидном
рафинировании. Для VBr2
— 263,3 кДж/моль; ур-ние температурной зависимости давления пара при 850-1016
°С: Igp(aT) = 2,56-5600/Т. Иодиды V-промежут. продукты при его иодидном
рафинировании. Для VBr2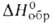 — 346,9 кДж/моль. VBr3 и VBr2 образуют аддукты с
пиридином, тетрагидрофураном, нитрилами, с жидким NH3 дают аммиакаты
соотв. VBr3*6NH3 и VBr2*6NH3.
— 346,9 кДж/моль. VBr3 и VBr2 образуют аддукты с
пиридином, тетрагидрофураном, нитрилами, с жидким NH3 дают аммиакаты
соотв. VBr3*6NH3 и VBr2*6NH3.
Лит.: Colton R., Canterford J. H., Halides of the transition
elements, L.-[a. o.], 1969, p. 107-60. Б.Г.Коршунов.


