ГИДРОФТОРИДЫ МЕТАЛЛОВ, неорганич. соединения, содержащие в молекуле катионы металлов и анионы HF2 или НnР-2+n; являются продуктами присоединения HF к фторидам металлов. Известны для щелочных, нек-рых щелхзем. металлов, Ag + , Tl + , Cu2 + , Zn2 + , Pb2 + , Cd2 + и др. Бесцв. кристаллы или жидкости с высокой электрич. проводимостью (см. табл.).
СВОЙСТВА ГИДРОФТОРИДОВ МЕТАЛЛОВ
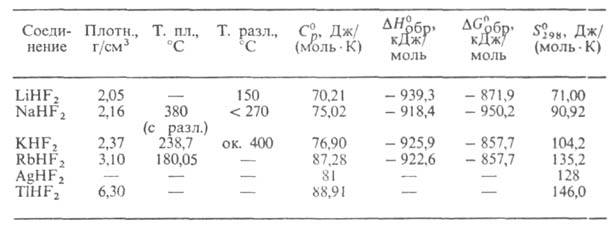
Г. м. при нагр. разлагаются с выделением HF. Высшие Г. м. (п 3)
разлагаются уже при комнатной т-ре. Т-ры плавления и разложения увеличиваются
с ростом ат. м. металла и уменьшаются с увеличением п. Напр., т-ры
плавления CsH2F3 и CsH6F7 равны
соответственно 50,2 и -42,3°С.
3)
разлагаются уже при комнатной т-ре. Т-ры плавления и разложения увеличиваются
с ростом ат. м. металла и уменьшаются с увеличением п. Напр., т-ры
плавления CsH2F3 и CsH6F7 равны
соответственно 50,2 и -42,3°С.
Г. м. хорошо раств. в жидком HF и почти не раств. в орг. р-рителях, гидрофториды щелочных металлов (кроме Na) хорошо раств. в воде.
Спектры комбинац. рассеяния и ИК-спектры содержат полосы поглощения при 1020-1250 и 1480-1800 см-1, характеристичные для иона HF~ (для изолированного иона 1217 и 1364 см-1).
При 100-200°С Г.м. взаимод. с Si, Al, Ti и нек-рыми др. металлами, оксидами (В2О3, SiO2, A12O3 и др.) и солями. Наиб. реакц. способностью обладают гидрофториды щелочных металлов.
Получают Г. м. взаимод. простых фторидов, оксидов или гидроксидов металлов, а также солей (напр., карбонатов) с HF, NH4HF2 или их водными р-рами. Г.м. - фторирующие агенты в произ-ве фторсодержащих орг. и неорг. соед.; компоненты электролитов для получения F2 и NF3, припоев и флюсов, р-ров для травления стекла, полупроводников и металлов; инсектициды; в лаборатории - источники безводного HF. Г. м.-промежут. продукты в произ-ве HF. Токсичны, ПДКр.з. 0,5 мг/м3 в пересчете на HF.
По св-вам к Г. м. близки гидрофториды аммония (см. Аммония фторид)и гидразина. Известны также двойные гидрофториды (напр., NH4HF2 *NaHF2).
Лит.: ОпаловскийА.А% Федотова Т. Д., Гидрофториды, Новосиб.,
1973; Основные свойства неорганических фторидов, М., 1976. Э.Г. Раков.


