ГЛУТАТИОН (L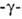 глутамил-L-цистеинилглицин,
GSH), мол. м. 263,1; бесцв. кристаллы; т. пл. 190°С (с разл.); раств. в
воде, не раств. в этаноле и эфире. При кипячении в воде образует пирролидонкарбоновую
к-ту и цистеинилглицин, при взаимод. с нитррпруссидом натрия в щелочной
среде дает красную окраску. Под действием мягких окислителей (напр., иода)
легко окисляется в дисульфид, что используют для количеств. определения
Г. (окислит.-восстановит. потенциал пары Г./дисульфид —0,24 В при рН 7).
глутамил-L-цистеинилглицин,
GSH), мол. м. 263,1; бесцв. кристаллы; т. пл. 190°С (с разл.); раств. в
воде, не раств. в этаноле и эфире. При кипячении в воде образует пирролидонкарбоновую
к-ту и цистеинилглицин, при взаимод. с нитррпруссидом натрия в щелочной
среде дает красную окраску. Под действием мягких окислителей (напр., иода)
легко окисляется в дисульфид, что используют для количеств. определения
Г. (окислит.-восстановит. потенциал пары Г./дисульфид —0,24 В при рН 7).
Специфич. метод определения Г. основан на его способности активировать превращ. метилглиоксаля в молочную к-ту под действием фермента глиоксалазы.
Г. найден у животных, растений, микроорганизмов. Его внутриклеточная
концентрация составляет 0,5-10 мМ, что существенно выше концентрации своб.
цистеина. Биол. ф-ции Г.: защищает SH-группы ферментов и др. белков от
окисления; восстанавливает Н2О2 и др. пероксиды;
связывает своб. радикалы; участвует в тиол-дисульфидном обмене и в обезвреживании
мн. чужеродных для организма соед. (см. Глутатионтрансферазы); восстанавливает
рибонуклеотиды в дезоксирибонуклеотиды; переносит аминокислоты через мембрану
клеток (см. Г
лутамилтрансфераза); является кофактором ряда ферментов, напр. глиоксалазы
и формальдегиддегидрогеназы.
Г
лутамилтрансфераза); является кофактором ряда ферментов, напр. глиоксалазы
и формальдегиддегидрогеназы.
Лит.: Торчинский Ю. М., Сера в белках. М., 1977; Meister A.,
Tate S.S., "Annual Review of Biochemistry", 1976, v. 45, p. 559-604; Holmgren
A., "The Journal of Biological Chemistry*. 1979, v. 254, № 9, p. 3664-78;
Meister A., "Trends in Biochemical Science", 1981, v. 6, № 9, p. 231-34.
Ю.М. Торчинский.


