ГОФМАНА РЕАКЦИИ. 1) Превращение амидов карбоновых к-т в первичные
амины с элиминированием СО2, происходящее под действием гипогалогенитов
щелочных металлов (перегруппировка Гофмана, расщепление амидов по Гофману):
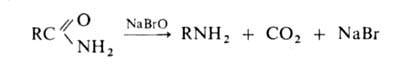
К водному щелочному р-ру гипогалогенита прибавляют амид: послед. нагревание
до 40-80°С завершает р-цию. Для увеличения выхода аминов из амидов высших
жирных к-т р-цию проводят в спиртовом р-ре. Образующиеся при этом уретаны
легко гидролизуются в амины. Первая стадия Г. р.-синтез N-галогенамида,
образующего под действием щелочей нестойкую соль I:
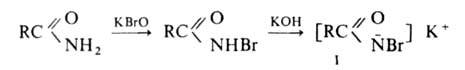
Стадия, определяющая скорость Г. р.,-отщепление галогена с образованием
нитрена II, к-рый стабилизируется перегруппировкой в изоцианат:
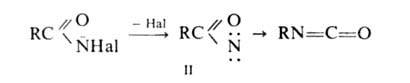
Последний при взаимод. с Н2О через карбаминовую к-ту превращ.
в амин:
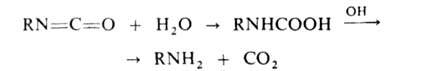
Установлено, что мигрирующая группа сохраняет конфигурацию. Нестойкий
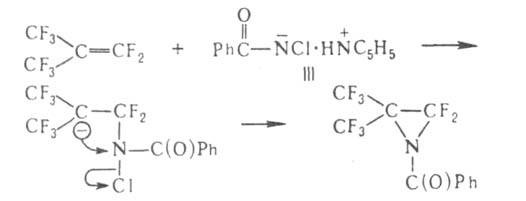
анион амида III может взаимод. с соед., содержащими электроф. кратные связи,
напр.:
Амиды гидроксикислот
и
гидроксикислот
и ненасыщенных
к-т в условиях Г. р. превращ. в альдегиды, амиды замещенных пропионовых
к-т-в нитрилы, амиды
ненасыщенных
к-т в условиях Г. р. превращ. в альдегиды, амиды замещенных пропионовых
к-т-в нитрилы, амиды ациламинокислот
- в ацилглиоксалидоны:
ациламинокислот
- в ацилглиоксалидоны:
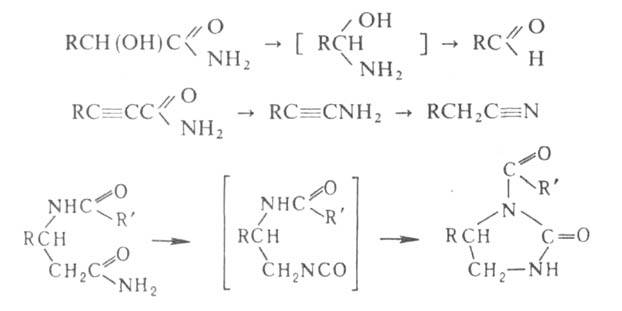
С помощью Г. р. можно получить с хорошими выходами алифатич., жирно-ароматич., ароматич. и гетероциклич. амины, диамины и аминокислоты; в пром-сти Г. р. используется для синтеза антраниловой к-ты.
Р-ция открыта А. В. Гофманом в 1881.
2) Разложение четвертичных аммониевых оснований, имеющих в углеродной
цепи атом Н в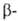 положении
к атому N, на третичный амин, олефин и воду (гофмановское расщепление):
положении
к атому N, на третичный амин, олефин и воду (гофмановское расщепление):
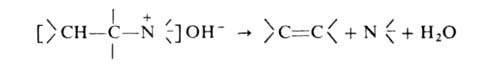
Обычно проводят путем упаривания водного или спиртового р-ра гидроксида
тетраалкиламмония (часто в вакууме) с постепенным повышением т-ры до 100-150
°С. Использование смеси безводных ДМСО и ТГФ позволяет снизить т-ру р-ции
до комнатной. Если атом N связан с разл. алкильными заместителями, то в
осн. образуется олефин с наименьшим числом алкильных групп у двойной связи
(правило Гофмана), напр.:
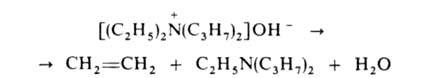
Заместители при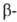 углеродном
атоме, способные к сопряжению и повышающие кислотность
углеродном
атоме, способные к сопряжению и повышающие кислотность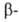 водорода
(напр., фенил), облегчают отщепление олефина. При наличии кратной связи
в
водорода
(напр., фенил), облегчают отщепление олефина. При наличии кратной связи
в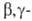 положении
отщепляется
положении
отщепляется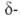 атом
водорода и происходит 1,4-элиминирование, напр.:
атом
водорода и происходит 1,4-элиминирование, напр.:
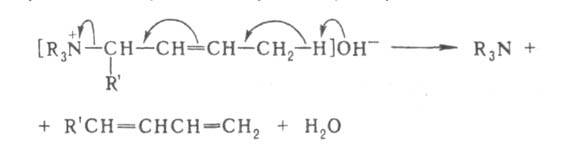
В случае двух сопряженных связей в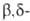 положении
происходит 1,6-элиминирование и образуется триен, напр.:
положении
происходит 1,6-элиминирование и образуется триен, напр.:
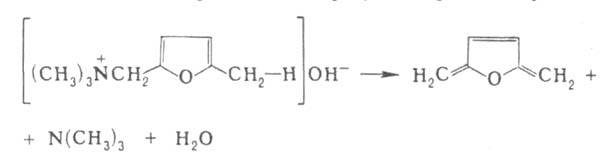
Г. р., как правило, протекает по механизму бимолекулярного элиминирования
и стереоспецифична, в нек-рых случаях-по внутримолекулярному циклич. механизму,
напр.:
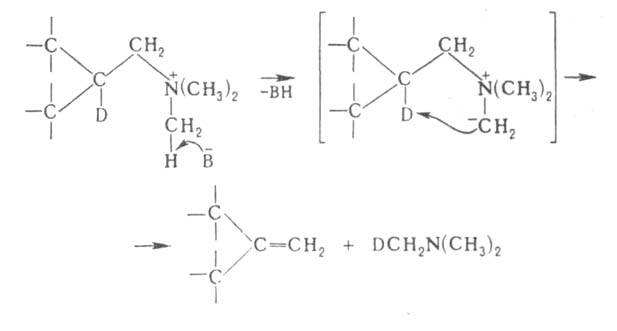
где В--основание.
Основные побочные процессы при Г. р.-образование спиртов, а также простых
эфиров, эпоксидов, производных ТГФ и циклопропана. В р-цию, подобную Г.
р., вступают соли сульфония и фосфония, напр.:
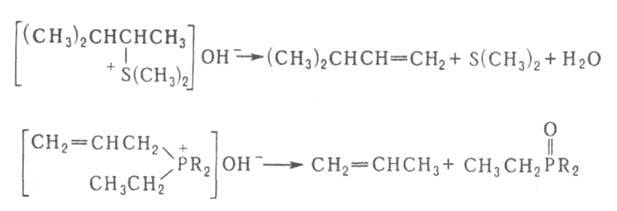
Г. р. применяют для синтеза непредельных соединений. Последовательное метилирование аминов и их расщепление (т. наз. исчерпывающее метилирование) используется для идентификации аминов.
Р-ция открыта А. В. Гофманом в 1851.
Лит.: Коп А. К., Тумбулл Э. Р., в сб.: Органические реакции, пер. с англ., сб. 11, М., 1965, с, 327-500; Мал пасс Д. Р., в кн.: Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 68-71. Н.П. Гамбарян.


