ИЗОКСАЗОЛ (1,2-оксазол), мол. м. 69.1; бесцв. жидкость с запахом пиридина; т. кип. 95,5 °С; d420 1,078; nD20 1,4298; рКа —2,03; ограниченно раств. в воде (1 маc. ч. в 6 маc. ч. воды при 20 °С), хорошо - в орг. р-рителях. Протонируется сильными к-тами по атому N.
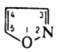
Под действием оснований депротонируется по атомам С-3 и С-5 с разрывом связи N—О и образованием a-кетонитрила. Обладает ароматич. св-вами. Для И. характерно электроф. замещение (нитрование, сульфирование, галогенирование) по атому С-4, для производных И. - нуклеоф. замещение по атомам С-3 и С-5. Алкилирование И. протекает по атому N. И. устойчив к действию окислителей, кроме КМnО4; восстановление приводит к разрыву цикла по связи N—О. Под действием света И. и его гомологи изомеризуются сначала в ацилазирины, затем в оксазолы, напр.:
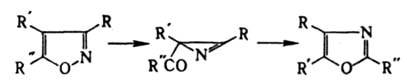
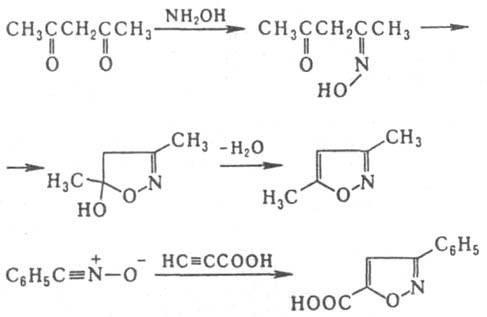
И. получают взаимод. гидроксил амина с пропаргиловым альдегидом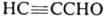 или его ацеталем. Производные И. синтезируют взаимод. гидроксиламина с b-дикарбонильными соед., а также циклоприсоединением N-оксидов нитрилов к алкинам, напр.:
или его ацеталем. Производные И. синтезируют взаимод. гидроксиламина с b-дикарбонильными соед., а также циклоприсоединением N-оксидов нитрилов к алкинам, напр.:
Производные И. широко используют в орг. химии для получения a,b-ненасыщенных кетонов, a-кетонитрилов, гетероциклич. соединений, а также в синтезе лек. ср-в (напр., циклосерина, оксациллина, клоксациллина). Лит.: Гетероциклические соединения, под ред. Р. Эльдерфильда, пер. с англ., т. 5, М., 1961. с. 368-92; Соколов С. Д., "Успехи химии", 1979, т. 48, в. 3, с. 533-62; Kochetkov N. K., Sokolov S. D., в кн. Advances in heterocyclic chemistry, v. 2, N.Y. L., 1965, p. 365-422. Б. Г. Горин.

Под действием оснований депротонируется по атомам С-3 и С-5 с разрывом связи N—О и образованием a-кетонитрила. Обладает ароматич. св-вами. Для И. характерно электроф. замещение (нитрование, сульфирование, галогенирование) по атому С-4, для производных И. - нуклеоф. замещение по атомам С-3 и С-5. Алкилирование И. протекает по атому N. И. устойчив к действию окислителей, кроме КМnО4; восстановление приводит к разрыву цикла по связи N—О. Под действием света И. и его гомологи изомеризуются сначала в ацилазирины, затем в оксазолы, напр.:

И. получают взаимод. гидроксил амина с пропаргиловым альдегидом
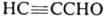 или его ацеталем. Производные И. синтезируют взаимод. гидроксиламина с b-дикарбонильными соед., а также циклоприсоединением N-оксидов нитрилов к алкинам, напр.:
или его ацеталем. Производные И. синтезируют взаимод. гидроксиламина с b-дикарбонильными соед., а также циклоприсоединением N-оксидов нитрилов к алкинам, напр.:

Производные И. широко используют в орг. химии для получения a,b-ненасыщенных кетонов, a-кетонитрилов, гетероциклич. соединений, а также в синтезе лек. ср-в (напр., циклосерина, оксациллина, клоксациллина). Лит.: Гетероциклические соединения, под ред. Р. Эльдерфильда, пер. с англ., т. 5, М., 1961. с. 368-92; Соколов С. Д., "Успехи химии", 1979, т. 48, в. 3, с. 533-62; Kochetkov N. K., Sokolov S. D., в кн. Advances in heterocyclic chemistry, v. 2, N.Y. L., 1965, p. 365-422. Б. Г. Горин.


