ИЗОТОПНЫЕ ЭФФЕКТЫ, различия в св-вах изотопов данного элемента или в св-вах соед., содержащих разл. изотопы одного элемента (т. наз. изотопнозамещенных соед.). Чаше всего обусловлены различиями масс ядер изотопов (И. э. I рода), но м. б. вызваны также различиями и др. ядерных св-в (И. э. II рода). И. э. I рода выражены тем сильнее, чем больше относит. разность масс соответствующих изотопов. Поэтому такие И. э. наиб. выражены у легких элементов (Н, Не, Li, Be, В, С). Если относит. различия атомных масс изотопов или мол. масс M1 и М2 двух изотопнозамещенных соед. малы [(М1 — М2)/М1 < 0,01 — 0,03], И. э. I рода пренебрежимо малы.
И. э. проявляются в том, что в-ва, отличающиеся изотопным составом, имеют разные физ. св-ва. Так, 4Не при сверхнизких т-рах переходит в сверхтекучее состояние, а 3Не таким св-вом не обладает. Вода состава Н2О имеет т. пл. 0°С, плотность при 20 °С 0,998 кг/дм3, а для воды состава D2O эти характеристики равны соотв. 3,82 °С и 1,104 кг/дм3.
И. э. подразделяют на термодинамич. и кинетические. К термодинамич. И. э. приводит нек-рое различие значений хим. потенциала в-в с изотопнозамещенными молекулами. Согласно статистич. термодинамике, это обусловлено различиями значений статистич. сумм изотопов и изотопнозамещенных молекул. Для разных изотопов одного элемента наблюдаются различия поступат. статистич. сумм; для двух-и многоатомных молекул разного изотопного состава еще и различия колебательной и вибрационной статистич. сумм. В результате термодинамич. св-ва в-в разного изотопного состава несколько разнятся между собой. Следствием этого является различие в равновесном распределении изотопов одного элемента между разными фазами, хим. формами и т. п. Константы равновесия К р-ций изотопного обмена с участием атомов легких элементов заметно отличаются от 1. Так, при 25 °С для р-ции Н2 + DCl D НСl + HD К = 1,45. С ростом ат. н. элемента термодинамич. И. э. быстро уменьшается. Напр., при 25° К = 1,003 для р-ции Н37Сl + 1/235Сl2 D Н35Сl + 1/237Сl2 и 1,0004 для аналогичной р-ции с участием 79Вr и 81Вr.
Кинетич. И. э. проявляются в различиях скоростей р-ций с участием разных изотопов данного элемента, изотопнозамещенных молекул или ионов. Различают межмол. и внутримол. И. э. Так, наблюдаемые константы скорости k1 и k2 декарбоксилирования малоновой к-ты разного изотопного состава
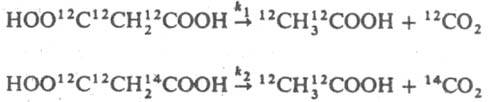
различаются из-за межмол. И. э., а значения k'1 и k'2 для р-ций
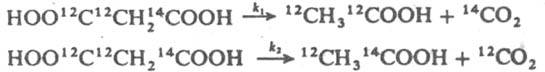
различаются из-за внутримол. И. э. В отличие от межмолекулярного, внутримол. И. э. не зависит от т-ры (подробнее см. Кинетический изотопный эффект). Разл. И. э. I рода лежат в основе большинства известных способов изотопов разделения. И. э. II рода обусловлены различиями таких св-в ядер, как спин, энергия g-квантов, испускаемых после захвата нейтрона, наличие изомерных состояний (см. Изомерия атомных ядер) и нек-рых др. Эти И. э. проявляются, напр., в неодинаковом распределении изотопов или ядерных изомеров между разл. хим. формами, содержащими ядра, к-рые образуются в результате захвата нейтронов. Так, после нейтронного облучения бромбензола содержание 80Вr в "материнской" форме на 10-15% ниже, чем 80mВr. И. э. могут приводить к различиям в частотах колебательных и вращательных спектров изотопнозамещенных соед.; эти различия наиб. существенны для молекул, содержащих изотопы водорода. Различия в энергиях основного квантового состояния атомных электронов, связанные с И. э., приводят, в частности, к разнице энергий диссоциации изотопнозамещенных молекул (напр., Н2, HD и D2). Следует отметить, что различия в периодах полураспада T1/2 радиоактивных изотопов данного элемента, а также в св-вах излучения, испускаемого ядрами при радиоактивном распаде, к И. э. относить не принято. Лит. см. при ст. Радиохимия. С. С. Бердоносов.
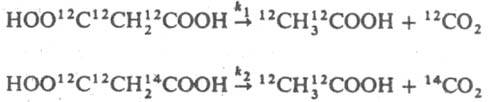
различаются из-за межмол. И. э., а значения k'1 и k'2 для р-ций
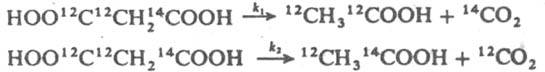
различаются из-за внутримол. И. э. В отличие от межмолекулярного, внутримол. И. э. не зависит от т-ры (подробнее см. Кинетический изотопный эффект). Разл. И. э. I рода лежат в основе большинства известных способов изотопов разделения. И. э. II рода обусловлены различиями таких св-в ядер, как спин, энергия g-квантов, испускаемых после захвата нейтрона, наличие изомерных состояний (см. Изомерия атомных ядер) и нек-рых др. Эти И. э. проявляются, напр., в неодинаковом распределении изотопов или ядерных изомеров между разл. хим. формами, содержащими ядра, к-рые образуются в результате захвата нейтронов. Так, после нейтронного облучения бромбензола содержание 80Вr в "материнской" форме на 10-15% ниже, чем 80mВr. И. э. могут приводить к различиям в частотах колебательных и вращательных спектров изотопнозамещенных соед.; эти различия наиб. существенны для молекул, содержащих изотопы водорода. Различия в энергиях основного квантового состояния атомных электронов, связанные с И. э., приводят, в частности, к разнице энергий диссоциации изотопнозамещенных молекул (напр., Н2, HD и D2). Следует отметить, что различия в периодах полураспада T1/2 радиоактивных изотопов данного элемента, а также в св-вах излучения, испускаемого ядрами при радиоактивном распаде, к И. э. относить не принято. Лит. см. при ст. Радиохимия. С. С. Бердоносов.


