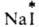 (здесь и далее знак * указывает радиоактивный атом), протекает в результате диссоциации
(здесь и далее знак * указывает радиоактивный атом), протекает в результате диссоциации 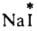 и AgI в р-ре. Обмен хлором между газообразным
и AgI в р-ре. Обмен хлором между газообразным 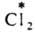 и парами FeCl3 также определяется диссоциацией FeCl3 при нагр. с образованием FeCl2 и атома Сl:
и парами FeCl3 также определяется диссоциацией FeCl3 при нагр. с образованием FeCl2 и атома Сl:
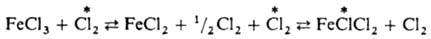
По ассоциативному механизму происходит И. о. иодом между алкилиодидом и иодидом натрия в спиртовом р-ре:
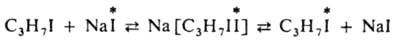
И. о., протекающий по механизму переноса электрона, - это обычная окислит.-восстановит. р-ция. Таков, напр., обмен между разл. изотопами Тl , входящими в состав TlNO3 и
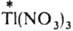 :
:

Механизм, связанный с перемещением групп атомов, часто наблюдается при гетерог. И. о.; так протекает, напр., И. о. углеродом между газообразным
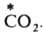 и твердым ВаСО3:
и твердым ВаСО3:
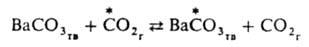
Кинетику И. о. обычно характеризуют степенью обмена F = (xt - х0)/(x: - x0), где x0, xt и x: - концентрации обменивающегося нуклида в к.-л. определенной форме, участвующей в обмене, соотв. в начальный момент времени t = 0, в момент времени t и при равнораспределении (t = :). Часто при t = 0 х = 0; тогда F = xt/x: (значение x: можно найти расчетом). Др. кинетич. характеристика И. о. - период полуобмена t1/2 - промежуток времени, в течение к-рого достигается F = 0,5. Зависимость между F и t1/2 описывается ур-нием:
-ln(1 - F) = (ln2/t1/2)t,
к-рое позволяет по эксперим. значениям F определить t1/2 и рассчитать константу скорости И. о. Напр., для бимолекулярного И. о. (р-ция второго порядка) константа скорости k равна:
k = (ln 2/t1/2)[1/(a + b)],
где а и b - молярные концентрации обменивающихся форм. Определив значения k при разных т-рах, можно на основании ур-ния Аррениуса найти энергию активации И. о., что позволяет, в частности, судить о прочности связи атомов, участвующих в И. о. Скорость гетерог. И. о. зависит как от скорости подвода и отвода обменивающихся атомов от пов-сти раздела фаз, так и непосредственно от скорости самого И. о. Если в И. о. участвует твердая фаза, то при достаточно интенсивном перемешивании паровой или жидкой фаз скорость всего процесса определяется скоростью диффузии обменивающегося атома от границы раздела фаз вовнутрь твердой фазы. И. о. используют при изотопов разделении, получении меченых соединений; с его помощью изучают строение молекул. На анализе И. о. основан один из способов определения низких давлений насыщенных паров. В отд. случаях И. о. может исказить результаты опыта; так, при изучении И. о. между в-вами, растворенными в воде, нужно учитывать возможность обмена изотопов водорода между исследуемыми в-вами и молекулами воды. Лит.: Несмеянов А. Н., Радиохимия. 2 изд., М., 1978, Радиоактивные индикаторы в химии. Основы метода, под ред. В. Б. Лукьянова. 3 изд., М., 1985. С. С. Бердоносов.


