ИЛИДЫ, соед. общей ф-лы I (п = 1-3 определяется валентностью атома Z); особый тип цвиттер-ионов.

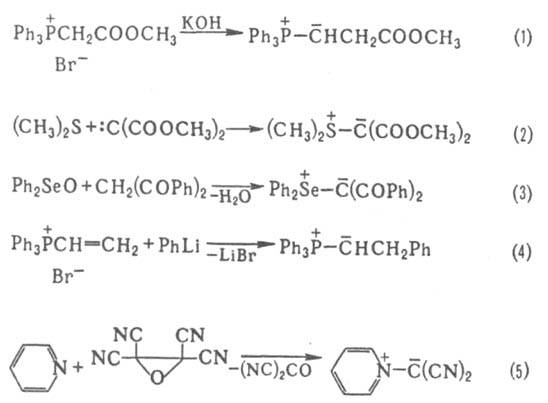
Известны для след. элементов Z: N, P, As, Sb, Bi, О, S, Se, Те, Cl, Вr, I. Для О зафиксированы только карбонил-илиды.
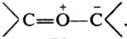
Наиб. изучены илиды P, S и N. Ониевый атом Z может входить в состав циклов, в т. ч. ароматического. Начиная с элементов 3-го периода в И. имеется определенная степень двоесвязанности (их строение м. б. описано резонансом структур I и II) между атомами Z и С, обусловленная взаимод. занятой p-орбитали атома С и вакантной d-орбитали атома Z. И. называют как ониевые соед. или как соед. со связью Z=C, напр.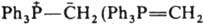 ) - трифенилфосфонийметилид, или метилентрифенилфосфоран.
Для нек-рых элементов, способных к расширению электронной оболочки, известны И. типа
) - трифенилфосфонийметилид, или метилентрифенилфосфоран.
Для нек-рых элементов, способных к расширению электронной оболочки, известны И. типа 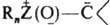 , напр., триметилсульфоксонийметилид
, напр., триметилсульфоксонийметилид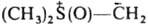 , более стабильные, чем их аналоги, не имеющие оксидного атома О.
Наличие при атоме С заместителей, способных к делокализации отрицат. заряда, напр. СН3СО, CN, NO2, а также включение атома С в ароматич. цикл стабилизирует И.; в этом случае они м. б. выделены и охарактеризованы. Др. И. малостабильны, чувствительны к влаге и О2 воздуха; их генерируют и используют в р-ре, часто в инертной атмосфере.
Для И. характерно взаимод. с электроф. реагентами. Так, a-атом Н легко замещается при алкилировании, ацилировании, галогенировании, напр.:
, более стабильные, чем их аналоги, не имеющие оксидного атома О.
Наличие при атоме С заместителей, способных к делокализации отрицат. заряда, напр. СН3СО, CN, NO2, а также включение атома С в ароматич. цикл стабилизирует И.; в этом случае они м. б. выделены и охарактеризованы. Др. И. малостабильны, чувствительны к влаге и О2 воздуха; их генерируют и используют в р-ре, часто в инертной атмосфере.
Для И. характерно взаимод. с электроф. реагентами. Так, a-атом Н легко замещается при алкилировании, ацилировании, галогенировании, напр.:
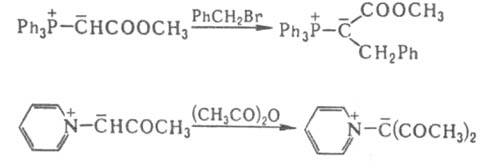
При протонировании И. к-тами образуются ониевые соли, напр.:
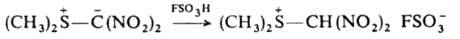
И., не имеющие электроакцепторных заместителей при атоме С, являются сильными основаниями и протонируются даже водой. С соед., содержащими электроф. двойные связи, И. реагируют с переносом алкилиденового фрагмента на эту связь. Процесс затруднен для И., стабилизированных двумя электроноакцепторными заместителями. При взаимод. альдегидов и кетонов с илидами Р образуются олефины (см. Виттига реакция), с илидами S - оксираны, напр.:
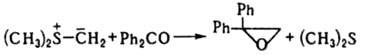
Аналогично с И. реагируют азометины и нитрозосоединения. Активир. олефины образуют с И. продукты циклопропанирования:
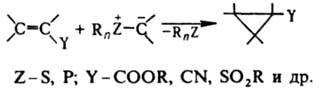
Нек-рые др. электрофилы присоединяются к И. по атому С, напр.:
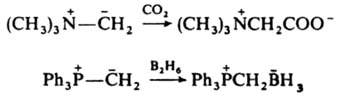
При действии нуклеофилов на И. может происходить их переилидирование, деалкилирование или экструзия гетероатома, напр.:
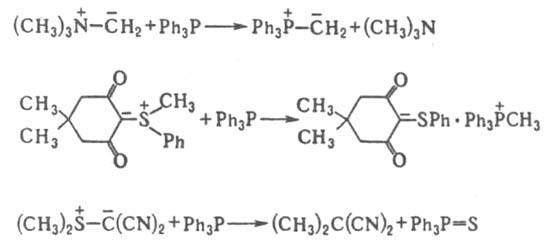
Илиды P, S и I способны гидролизоваться по двум направлениям, напр.:
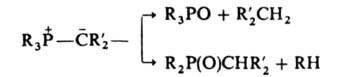
Илиды N и S при нагр. претерпевают [1, 2]-сигматропную перегруппировку, напр.:
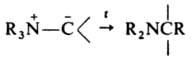
Для илидов S, кроме того, характерны [2, 3]-сигматропные термич. перегруппировки, напр.:
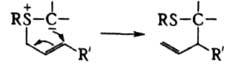
Термическое, каталитич. или фотохим. расщепление И. часто приводит к карбенам с послед. образованием олефинов и (или) циклопропанов:
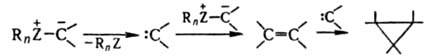
Осн. способы получения И.: депротонирование ониевых солей в присут. оснований, напр., ур-ние 1, карбеновый метод (2); из активир. метиленовых соед. (3); алкилированием, ацилированием, галогенированием, переилидированием др. И., нуклеоф. присоединением к винилзамещенным ониевым солям (4); из активир. оксиранов (5).
И. широко используются в орг. синтезе для создания новых связей С—С. Лит.: Джонсон А., Химия илидов, пер. с англ., М., 1969; Садеков И. Д. [и др.], "Успехи химии", 1981, т. 50, в. 5, с. 813-59; Белкин Ю. В., Полежаева Н. А., там же, с. 909-42; Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 108, 403. С. А. Шевелев.

Известны для след. элементов Z: N, P, As, Sb, Bi, О, S, Se, Те, Cl, Вr, I. Для О зафиксированы только карбонил-илиды.
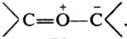
Наиб. изучены илиды P, S и N. Ониевый атом Z может входить в состав циклов, в т. ч. ароматического. Начиная с элементов 3-го периода в И. имеется определенная степень двоесвязанности (их строение м. б. описано резонансом структур I и II) между атомами Z и С, обусловленная взаимод. занятой p-орбитали атома С и вакантной d-орбитали атома Z. И. называют как ониевые соед. или как соед. со связью Z=C, напр.
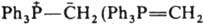 ) - трифенилфосфонийметилид, или метилентрифенилфосфоран.
Для нек-рых элементов, способных к расширению электронной оболочки, известны И. типа
) - трифенилфосфонийметилид, или метилентрифенилфосфоран.
Для нек-рых элементов, способных к расширению электронной оболочки, известны И. типа 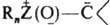 , напр., триметилсульфоксонийметилид
, напр., триметилсульфоксонийметилид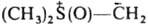 , более стабильные, чем их аналоги, не имеющие оксидного атома О.
Наличие при атоме С заместителей, способных к делокализации отрицат. заряда, напр. СН3СО, CN, NO2, а также включение атома С в ароматич. цикл стабилизирует И.; в этом случае они м. б. выделены и охарактеризованы. Др. И. малостабильны, чувствительны к влаге и О2 воздуха; их генерируют и используют в р-ре, часто в инертной атмосфере.
Для И. характерно взаимод. с электроф. реагентами. Так, a-атом Н легко замещается при алкилировании, ацилировании, галогенировании, напр.:
, более стабильные, чем их аналоги, не имеющие оксидного атома О.
Наличие при атоме С заместителей, способных к делокализации отрицат. заряда, напр. СН3СО, CN, NO2, а также включение атома С в ароматич. цикл стабилизирует И.; в этом случае они м. б. выделены и охарактеризованы. Др. И. малостабильны, чувствительны к влаге и О2 воздуха; их генерируют и используют в р-ре, часто в инертной атмосфере.
Для И. характерно взаимод. с электроф. реагентами. Так, a-атом Н легко замещается при алкилировании, ацилировании, галогенировании, напр.:

При протонировании И. к-тами образуются ониевые соли, напр.:
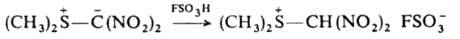
И., не имеющие электроакцепторных заместителей при атоме С, являются сильными основаниями и протонируются даже водой. С соед., содержащими электроф. двойные связи, И. реагируют с переносом алкилиденового фрагмента на эту связь. Процесс затруднен для И., стабилизированных двумя электроноакцепторными заместителями. При взаимод. альдегидов и кетонов с илидами Р образуются олефины (см. Виттига реакция), с илидами S - оксираны, напр.:
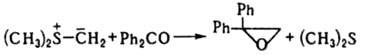
Аналогично с И. реагируют азометины и нитрозосоединения. Активир. олефины образуют с И. продукты циклопропанирования:
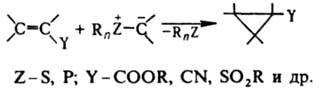
Нек-рые др. электрофилы присоединяются к И. по атому С, напр.:
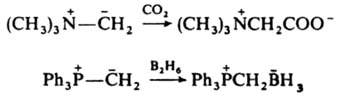
При действии нуклеофилов на И. может происходить их переилидирование, деалкилирование или экструзия гетероатома, напр.:

Илиды P, S и I способны гидролизоваться по двум направлениям, напр.:

Илиды N и S при нагр. претерпевают [1, 2]-сигматропную перегруппировку, напр.:
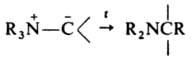
Для илидов S, кроме того, характерны [2, 3]-сигматропные термич. перегруппировки, напр.:

Термическое, каталитич. или фотохим. расщепление И. часто приводит к карбенам с послед. образованием олефинов и (или) циклопропанов:
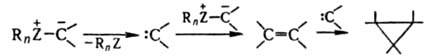
Осн. способы получения И.: депротонирование ониевых солей в присут. оснований, напр., ур-ние 1, карбеновый метод (2); из активир. метиленовых соед. (3); алкилированием, ацилированием, галогенированием, переилидированием др. И., нуклеоф. присоединением к винилзамещенным ониевым солям (4); из активир. оксиранов (5).

И. широко используются в орг. синтезе для создания новых связей С—С. Лит.: Джонсон А., Химия илидов, пер. с англ., М., 1969; Садеков И. Д. [и др.], "Успехи химии", 1981, т. 50, в. 5, с. 813-59; Белкин Ю. В., Полежаева Н. А., там же, с. 909-42; Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 108, 403. С. А. Шевелев.


