ИНИЦИАТОРЫ РАДИКАЛЬНЫЕ (от позднелат. initiator -зачинатель), в-ва, способные зарождать (инициировать) цепные радикальные процессы в результате распада или др. хим. р-ций образования радикалов свободных. К таким процессам относятся, напр., радикальная полимеризация, окисление орг. соединений, радикально-цепное хлорирование и сульфохлорирование, теломеризация, структурирование полимеров. Иногда термин "инициатор" используют для обозначения в-в, возбуждающих ионную полимеризацию, если они необратимо расходуются на стадии инициирования (см. Катализаторы полимеризации).
В качестве И. р. на практике чаще всего используют орг. и неорг. пероксиды, азосоединения, N-нитрозоанилиды, триазены, элементоорг. соед. (в т.ч. карбонилы металлов), дибензилы. Концентрация И. р. в среднем составляет 10-2 моль/л; при инициировании, напр., полимеризации метилметакрилата 2,2'-азо-бис-изобутиронитрилом она равна 10-3 — 5.10-1 моль/л, а бензоилпероксидом - 5.10-4 —10-1 моль/л, при инициировании полимеризации стирола бензоилпероксидом -10-4-2.10-1 моль/л.
Орг. пероксиды и азосоединения - наиб. распространенные И. р., из них в пром-сти широко применяют бензоилпероксид, трет-бутилгидропероксид, трет-бутилпероксид, кумилгидропероксид, кумилпероксид, 2,2'-азо-бис-изобутиронитрил; из неорг. пероксидов наиб. важен водорода пероксид, из элементоорганических ацетилциклогексилсульфонилпероксид C6H11SO2OOC(O)CH3 и три-(трет-бутилперокси)винилкремний (C4H9OO)3SiCH=CH2. В нек-рых процессах И. р. может служить О2. Своб. радикалы в большинстве случаев генерируются в результате термич. или фотохим. распада И. р. или при окислит.-восстановит. р-циях. О генерировании радикалов путем фотолиза см. Фотохимические реакции.
Пероксиды, азосоединения и дибензилы типа [С6Н5С(СН3)2-]2, [С6Н5С(СН3)(С2Н5)-]2 и [п-CH3OC6H4C(OC2H5)(CN)—]2, содержащие слабые связи соотв. О—О, С—N и С—С, используют для термич. генерирования своб. радикалов. При термолизе у пероксидов, как правило, первоначально гомолитически разрывается связь О—О (энергия активации Еакт = 115-170 кДж/моль), у азосоединений - обе связи С—N и выделяется N2 (Eакт = 110-145 кДж/моль). Распад при нагр., напр., N-нитрозоанилидов и триазенов происходит соотв. по ур-ниям:
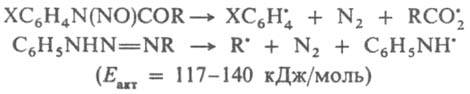
Своб. радикалы возникают также при разрыве лабильных связей в группировках —О—О—, —N=N— или др. предварительно введенных в макромолекулы полимеров. Эти р-ции используют для получения привитых и блоксополимеров, сетчатых полимеров. При проведении процесса в р-ре в результате клетки эффекта первичные радикальные продукты распада могут рекомбинировать и диспропорционировать, давая стабильные молекулы, что приводит к снижению эффективности инициирования. Р-ции в окислит.-восстановит. системах осуществляются с переносом одного электрона или частицы, несущей неспаренный электрон. В этих случаях образуется один радикал, что исключает эффект клетки. Участие в окислит.-восстановит. процессе одновременно двух и более молекул позволяет, варьируя их концентрации, легко регулировать суммарную скорость инициирования, а благодаря низким энергиям активаций лимитирующих стадий образования радикалов (30-45 кДж/моль) последние генерируются при комнатной и более низких т-рах. Ниже приведены окислит.-восстановит. системы, наиб. широко применяемые в качестве И. р. Система H2O2-FeSO4, наз. реактивом Фентона, генерирует радикалы по схеме:
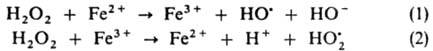
Стадия (1) лимитирует суммарную скорость процесса (Еакт = 39,3 кДж/моль). По аналогичной схеме происходит генерирование радикалов в системах гидропероксида кумола, диизопропилбензола или п-ментана в сочетании с FeSО4:
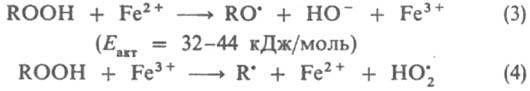
Общая скорость генерирования радикалов определяется скоростью восстановления Fe3+ в Fe2+, поэтому в пром. системы вводят дополнительно восстановители, напр., фруктозу и др. углеводы, гидразин, ронгалит NaHSO2.СН2О.2Н2О. Системы, состоящие из пероксодисульфатов и солей Fe(II), генерируют радикалы по схеме: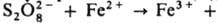
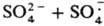 (Еакт = 50,7 кДж/моль).
В системах, содержащих бензоилперокрид или др. пероксиды ацилов в сочетании с диалкиланилином, перенос электрона осуществляется через промежуточный комплекс с образованием ион-радикальной пары по реакции:
(Еакт = 50,7 кДж/моль).
В системах, содержащих бензоилперокрид или др. пероксиды ацилов в сочетании с диалкиланилином, перенос электрона осуществляется через промежуточный комплекс с образованием ион-радикальной пары по реакции:
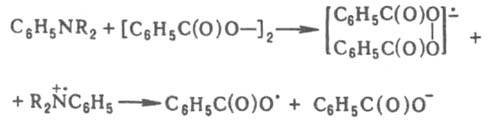
Карбонилы металлов переменной валентности генерируют радикалы в результате переноса электрона от металла к галогенсодержащим соед.:
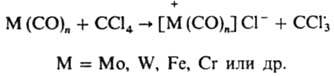
Их применяют главным образом для инициирования радикальной теломеризации с разрывом связей С—Hal, С—S, С—N. Мировое произ-во азосоединений достигло в 1985 неск. тыс. т, орг. пероксидов в США - ок. 20 тыс. т. Свыше половины общего объема выпускаемых в пром-сти полимерных материалов производится и перерабатывается с применением И. р. Лит.: Семенов Н. Н., О некоторых проблемах химической кинетики и реакционной способности, 2 изд., М., 1958; Розанцев Э. Г, Шолле В. Д., Органическая химия свободных радикалов, М., 1979; Долгоплоск Б. А., Тинякова Е. И., Генерирование свободных радикалов и их реакции, М., 1982; Антоновский В. Л., Инициаторы, М. (в печати). В. Л. Антоновский.
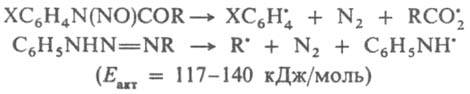
Своб. радикалы возникают также при разрыве лабильных связей в группировках —О—О—, —N=N— или др. предварительно введенных в макромолекулы полимеров. Эти р-ции используют для получения привитых и блоксополимеров, сетчатых полимеров. При проведении процесса в р-ре в результате клетки эффекта первичные радикальные продукты распада могут рекомбинировать и диспропорционировать, давая стабильные молекулы, что приводит к снижению эффективности инициирования. Р-ции в окислит.-восстановит. системах осуществляются с переносом одного электрона или частицы, несущей неспаренный электрон. В этих случаях образуется один радикал, что исключает эффект клетки. Участие в окислит.-восстановит. процессе одновременно двух и более молекул позволяет, варьируя их концентрации, легко регулировать суммарную скорость инициирования, а благодаря низким энергиям активаций лимитирующих стадий образования радикалов (30-45 кДж/моль) последние генерируются при комнатной и более низких т-рах. Ниже приведены окислит.-восстановит. системы, наиб. широко применяемые в качестве И. р. Система H2O2-FeSO4, наз. реактивом Фентона, генерирует радикалы по схеме:
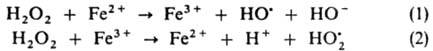
Стадия (1) лимитирует суммарную скорость процесса (Еакт = 39,3 кДж/моль). По аналогичной схеме происходит генерирование радикалов в системах гидропероксида кумола, диизопропилбензола или п-ментана в сочетании с FeSО4:
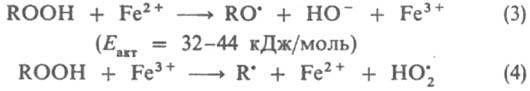
Общая скорость генерирования радикалов определяется скоростью восстановления Fe3+ в Fe2+, поэтому в пром. системы вводят дополнительно восстановители, напр., фруктозу и др. углеводы, гидразин, ронгалит NaHSO2.СН2О.2Н2О. Системы, состоящие из пероксодисульфатов и солей Fe(II), генерируют радикалы по схеме:
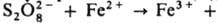
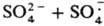 (Еакт = 50,7 кДж/моль).
В системах, содержащих бензоилперокрид или др. пероксиды ацилов в сочетании с диалкиланилином, перенос электрона осуществляется через промежуточный комплекс с образованием ион-радикальной пары по реакции:
(Еакт = 50,7 кДж/моль).
В системах, содержащих бензоилперокрид или др. пероксиды ацилов в сочетании с диалкиланилином, перенос электрона осуществляется через промежуточный комплекс с образованием ион-радикальной пары по реакции:
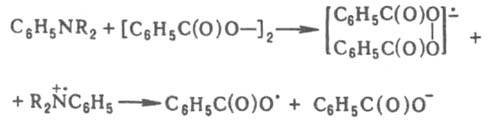
Карбонилы металлов переменной валентности генерируют радикалы в результате переноса электрона от металла к галогенсодержащим соед.:
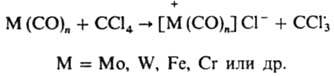
Их применяют главным образом для инициирования радикальной теломеризации с разрывом связей С—Hal, С—S, С—N. Мировое произ-во азосоединений достигло в 1985 неск. тыс. т, орг. пероксидов в США - ок. 20 тыс. т. Свыше половины общего объема выпускаемых в пром-сти полимерных материалов производится и перерабатывается с применением И. р. Лит.: Семенов Н. Н., О некоторых проблемах химической кинетики и реакционной способности, 2 изд., М., 1958; Розанцев Э. Г, Шолле В. Д., Органическая химия свободных радикалов, М., 1979; Долгоплоск Б. А., Тинякова Е. И., Генерирование свободных радикалов и их реакции, М., 1982; Антоновский В. Л., Инициаторы, М. (в печати). В. Л. Антоновский.


