КОРТИКОИДЫ (кортикостероиды), прир. стероидные гормоны, вырабатываемые корой надпочечников позвоночных. Относятся к С21 - стероидам, в основе к-рых лежит скелет прегнана (ф-ла I). По физиол. действию условно подразделяются на глюко- и минералокортикоиды. Первые
преим. регулируют обмен глюкозы в организме, вторые - обмен воды и ионов (Na+, К+).
Назв. К., по номенклатуре ИЮПАК, включает корень "прегн" с разл. окончаниями: для насыщенных К.- "ан", ненасыщенных-"ен", гидроксилсодержащих -"ол", карбонилсодержащих - "он" и т.д.; префиксы "нор" и "гомо" используют для обозначения утраченных или дополнит. углеродных атомов, "секо" - для обозначения места разрыва кольца. Буквами a и b обозначают заместители, расположенные соотв. под и над плоскостью молекулы скелета. Применяют также тривиальные, а для синтетич. К. фирменные названия.
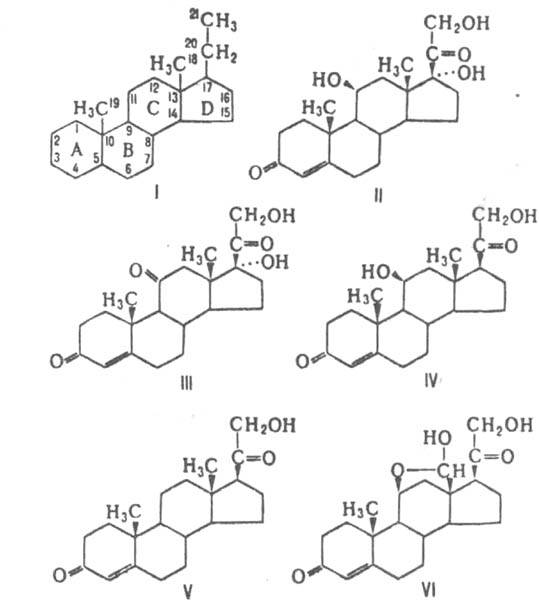
Из экстракта надпочечников (т. наз. кортина) выделено 46 прир. К., из к-рых наиб. значение для жизнедеятельности организма имеют: из глюкокортикоидов - кортизол (II), кортизон (III), кортикостерон (IV); из минсралокортикоидов -кортексон (V) и альдостерон (VI). Св-ва этих К. представлены в таблице.

Хим. св-ва К. определяются наличием a,b - ненасыщенной кетонной группировки в кольце А и кетольной группировки в боковой цепи кольца D. Кетогруппа и гидроксил в положении II из-за стерич. препятствий химически довольно инертны: по II-кетогруппе не образуются гидразоны и семикарбазоны, IIb - гидроксильная группа в обычных условиях не ацилируется. Биосинтез К. происходит в надпочечниках из холестерина, к-рый превращ. последовательно в прегненолон (Зb-гидрокси-5-прегнен-20-он) и прогестерон (см. Гестагены). Последний подвергается ферментативному гидроксилиpованию в положение 17 с образованием 17a-производного и его послед. превращением или в положение 21 с образованием кортексона и далее кортикостерона и альдостерона. Биол. св-ва и действия К. весьма многообразны. Удаление надпочечников (адреналэктомия) приводит, с одной стороны, к непрерывной потере организмом Na+ и воды при одноврем. росте содержания К+ , с другой - к резкому падению содержания гликогена в печени и сахара в крови. Первое явление может быть ликвидировано введением минералокортикоидов, второе - введением глюкокортикоидов. наиб. сильным глюкокортикоидным эффектом среди прир. К. обладает кортизол. Однако его минералокортикоидное действие в 5000 раз ниже, чем у альдостерона. В свою очередь, глюкокортикоидное действие последнего в 4 раза ниже, чем у кортизола. В то же время глюкокортикоиды помимо регуляции обмена углеводов стимулируют деятельность сердечной мышцы, подавляют иммунитет, проявляют противовоспалит. действие и т.д. Минералокортикоиды оказывают действие на центр. нервную систему, проницаемость мембран и т. д. Вопреки ранее принятому взгляду на К. как на катаболич. стероиды, они проявляют избират. анаболич. действие, в частности гепатотропное, лиенотропное и др. Согласно существующим представлениям, К. осуществляют свои биол. ф-ции, связываясь с белками-рецепторами в активный комплекс, к-рый действует на геном, вызывая экспрессию генов. Так, усиление отложения гликогена в печени связано со стимуляцией активности трансаминазы за счет повышения синтеза фермента. Не исключено и мембранное действие К. Регуляция биосинтеза глюкокортикоидов надпочечниками производится в организме действием адренокортикотропного гормона (АКТГ), выделяемого гипофизом под влиянием обратной связи через гипоталамус. Механизм регуляции биосинтеза минералокортикоидов достоверно не установлен. Нормальный уровень биосинтеза К. организма у человека составляет 20-30 мг кортизола, 2-4 мг кортикостерона и 20-200 мкг альдостерона. Сильный выброс К. надпочечниками происходит при стрессе. Стойкие нарушения баланса К. приводят к ряду заболеваний: отдельные виды гипертонии (гиперальдостеронии, гиперминералокортицизм), болезнь Аддисона, синдром Кушинга и др. Инактивация К. происходит в печени путем частичного восстановления и связывания глюкуроновыми и серной к-тами. К. и продукты их метаболизма быстро выводятся из организма, гл. обр. с мочой. Мед. использование прир. К. затрудняется многосторонностью их биол. действия (мультифункциональностью) и подавлением гормонопроизводящей деятельности надпочечников. Были предприняты исследования по поиску аналогов глюкокортикоидов с узким спектром биол. действия. наиб. перспективным оказалось введение двойной связи в положение 1,2, атомов F в положения 6a и 9a, СН3 или НО-групп в положение 16. Из синтетич. аналогов наиб. известны преднизолон (11b, 17a, 21-тригидроксипрегна-1,4-диен-3,20-дион), десонид (110, 16a, 17a, 21-тетрагидрокси-прегна-1,4-диен-3,20-дион), триамцинолон (11b, 16a, 17a, 21-тетрагидрокси-9a-фторпрегна-1,4-диен-3,20-дион), синалар (11b, 21-дигидрокси-6a, 9a-дифтор-16a, 17a-диметилметилендиоксипрегна-1,4-диен-3,20-дион), дексаметазон (11b, 17a, 21-тригидрокси-9a-фтор-1бa-метилпрегна-1,4-диен-3,20-дион) и др., обладающие высоким противовоспалит. действием и почти не влияющие на обмен ионов. Общий недостаток, ограничивающий применение К., - иммунодепрессивное действие. Минералокортикоиды и их аналоги самостоят, мед. значения не имеют. Применение находят их антагонисты - 17-спиролактоны. Пром. методы получения глюкокортикоидов исходят из прир. генинов спиростанового ряда (напр., диосгенин) или стероидных алкалоидов (напр., соласодин), деградацией к-рых получают ацетат 16-дегидропрегненолона (АДП; VII). Последний превращают в кортизол (II) по схеме:
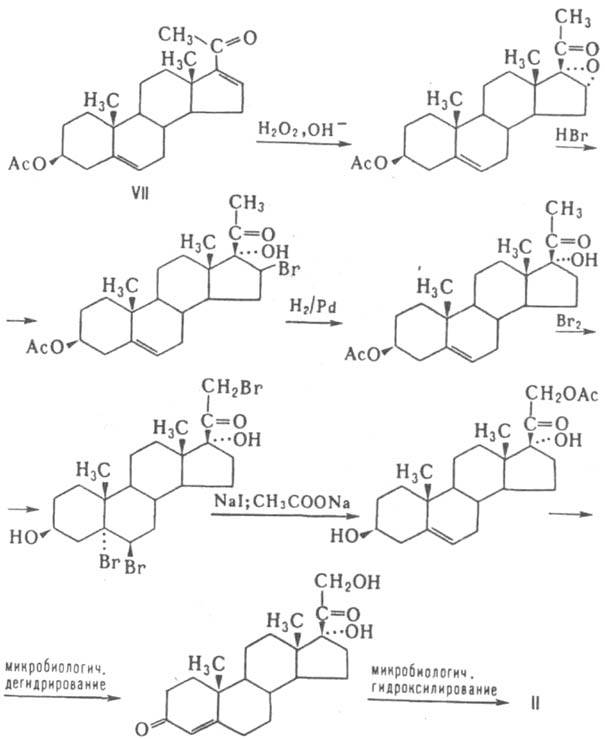
Введение атома фтора в положение 9а осуществляют обычно через дегидратацию 11-гидроксильной группы, введение (через бромгидрин) оксидного кольца в положение 9b, 11b и его раскрытие - под действием HF. Введение 1,2-двойной связи осуществляется микробиол. путем. Используют также пром. синтезы глюкокортикоидов, исходящие из 17-кетостероидов, получаемых микробиол. деградацией стеринов. Полный синтез К. пром. применения еще не нашел. Синтез альдостерона основан на фотохим. превращ. 11-нитрита кортикостерона в оксим 18-карбальдегида. Применяют К. в медицине при заместительной терапии и в качестве антивоспалит., антиревматоидных, антиаллергич. и иммунодепрессивных ср-в. К. и их аналоги ввиду жесткости скелета - удобные модели в конформац. анализе. Лит.: Скрябин Г. К., Головлева Л. А., Использование микроорганизмов в органическом синтезе, М., 1976; Физер Л.. Физер М., Стероиды, пер. с англ., М., 1964; Хефтман Э.. Биохимия стероидов, пер. с англ., М., 1972; Гёрёг Ш., Количественный анализ стероидов, пер. с англ., М., 1985; Chemie steroidnich sloucenin, Praha, 1960; Wiechert R., Laurent H., Pregnanes and corticoids, в кн.: Organic chemistry, ser. 1, ed. by D. H. Hey, v. 8 Steroids, L. Baltimore, 1973 (MTP International Review of Science), p. 107 50; то же. там же, ser. 2, v. 8 Steroids, L.-[a. o.], 1976, p. 115-43. А. В. Камерницкий.

Из экстракта надпочечников (т. наз. кортина) выделено 46 прир. К., из к-рых наиб. значение для жизнедеятельности организма имеют: из глюкокортикоидов - кортизол (II), кортизон (III), кортикостерон (IV); из минсралокортикоидов -кортексон (V) и альдостерон (VI). Св-ва этих К. представлены в таблице.

Хим. св-ва К. определяются наличием a,b - ненасыщенной кетонной группировки в кольце А и кетольной группировки в боковой цепи кольца D. Кетогруппа и гидроксил в положении II из-за стерич. препятствий химически довольно инертны: по II-кетогруппе не образуются гидразоны и семикарбазоны, IIb - гидроксильная группа в обычных условиях не ацилируется. Биосинтез К. происходит в надпочечниках из холестерина, к-рый превращ. последовательно в прегненолон (Зb-гидрокси-5-прегнен-20-он) и прогестерон (см. Гестагены). Последний подвергается ферментативному гидроксилиpованию в положение 17 с образованием 17a-производного и его послед. превращением или в положение 21 с образованием кортексона и далее кортикостерона и альдостерона. Биол. св-ва и действия К. весьма многообразны. Удаление надпочечников (адреналэктомия) приводит, с одной стороны, к непрерывной потере организмом Na+ и воды при одноврем. росте содержания К+ , с другой - к резкому падению содержания гликогена в печени и сахара в крови. Первое явление может быть ликвидировано введением минералокортикоидов, второе - введением глюкокортикоидов. наиб. сильным глюкокортикоидным эффектом среди прир. К. обладает кортизол. Однако его минералокортикоидное действие в 5000 раз ниже, чем у альдостерона. В свою очередь, глюкокортикоидное действие последнего в 4 раза ниже, чем у кортизола. В то же время глюкокортикоиды помимо регуляции обмена углеводов стимулируют деятельность сердечной мышцы, подавляют иммунитет, проявляют противовоспалит. действие и т.д. Минералокортикоиды оказывают действие на центр. нервную систему, проницаемость мембран и т. д. Вопреки ранее принятому взгляду на К. как на катаболич. стероиды, они проявляют избират. анаболич. действие, в частности гепатотропное, лиенотропное и др. Согласно существующим представлениям, К. осуществляют свои биол. ф-ции, связываясь с белками-рецепторами в активный комплекс, к-рый действует на геном, вызывая экспрессию генов. Так, усиление отложения гликогена в печени связано со стимуляцией активности трансаминазы за счет повышения синтеза фермента. Не исключено и мембранное действие К. Регуляция биосинтеза глюкокортикоидов надпочечниками производится в организме действием адренокортикотропного гормона (АКТГ), выделяемого гипофизом под влиянием обратной связи через гипоталамус. Механизм регуляции биосинтеза минералокортикоидов достоверно не установлен. Нормальный уровень биосинтеза К. организма у человека составляет 20-30 мг кортизола, 2-4 мг кортикостерона и 20-200 мкг альдостерона. Сильный выброс К. надпочечниками происходит при стрессе. Стойкие нарушения баланса К. приводят к ряду заболеваний: отдельные виды гипертонии (гиперальдостеронии, гиперминералокортицизм), болезнь Аддисона, синдром Кушинга и др. Инактивация К. происходит в печени путем частичного восстановления и связывания глюкуроновыми и серной к-тами. К. и продукты их метаболизма быстро выводятся из организма, гл. обр. с мочой. Мед. использование прир. К. затрудняется многосторонностью их биол. действия (мультифункциональностью) и подавлением гормонопроизводящей деятельности надпочечников. Были предприняты исследования по поиску аналогов глюкокортикоидов с узким спектром биол. действия. наиб. перспективным оказалось введение двойной связи в положение 1,2, атомов F в положения 6a и 9a, СН3 или НО-групп в положение 16. Из синтетич. аналогов наиб. известны преднизолон (11b, 17a, 21-тригидроксипрегна-1,4-диен-3,20-дион), десонид (110, 16a, 17a, 21-тетрагидрокси-прегна-1,4-диен-3,20-дион), триамцинолон (11b, 16a, 17a, 21-тетрагидрокси-9a-фторпрегна-1,4-диен-3,20-дион), синалар (11b, 21-дигидрокси-6a, 9a-дифтор-16a, 17a-диметилметилендиоксипрегна-1,4-диен-3,20-дион), дексаметазон (11b, 17a, 21-тригидрокси-9a-фтор-1бa-метилпрегна-1,4-диен-3,20-дион) и др., обладающие высоким противовоспалит. действием и почти не влияющие на обмен ионов. Общий недостаток, ограничивающий применение К., - иммунодепрессивное действие. Минералокортикоиды и их аналоги самостоят, мед. значения не имеют. Применение находят их антагонисты - 17-спиролактоны. Пром. методы получения глюкокортикоидов исходят из прир. генинов спиростанового ряда (напр., диосгенин) или стероидных алкалоидов (напр., соласодин), деградацией к-рых получают ацетат 16-дегидропрегненолона (АДП; VII). Последний превращают в кортизол (II) по схеме:

Введение атома фтора в положение 9а осуществляют обычно через дегидратацию 11-гидроксильной группы, введение (через бромгидрин) оксидного кольца в положение 9b, 11b и его раскрытие - под действием HF. Введение 1,2-двойной связи осуществляется микробиол. путем. Используют также пром. синтезы глюкокортикоидов, исходящие из 17-кетостероидов, получаемых микробиол. деградацией стеринов. Полный синтез К. пром. применения еще не нашел. Синтез альдостерона основан на фотохим. превращ. 11-нитрита кортикостерона в оксим 18-карбальдегида. Применяют К. в медицине при заместительной терапии и в качестве антивоспалит., антиревматоидных, антиаллергич. и иммунодепрессивных ср-в. К. и их аналоги ввиду жесткости скелета - удобные модели в конформац. анализе. Лит.: Скрябин Г. К., Головлева Л. А., Использование микроорганизмов в органическом синтезе, М., 1976; Физер Л.. Физер М., Стероиды, пер. с англ., М., 1964; Хефтман Э.. Биохимия стероидов, пер. с англ., М., 1972; Гёрёг Ш., Количественный анализ стероидов, пер. с англ., М., 1985; Chemie steroidnich sloucenin, Praha, 1960; Wiechert R., Laurent H., Pregnanes and corticoids, в кн.: Organic chemistry, ser. 1, ed. by D. H. Hey, v. 8 Steroids, L. Baltimore, 1973 (MTP International Review of Science), p. 107 50; то же. там же, ser. 2, v. 8 Steroids, L.-[a. o.], 1976, p. 115-43. А. В. Камерницкий.


