МЕТАНСУЛЬФОКИСЛОТА (метилсульфоновая
к-та) CH3SO3H, мол. м. 96,1; желтая жидкость; т. пл. 20
°С, т. кип. 167-167,5 °С/10 мм рт. ст.;d425
1,4844; nD20 1,4303; сильная к-та, К (вода,
25 °С) 5,45•10-2. Смешивается с водой, раств. в полярных орг.
р-рителях.
По хим. cв-вам-типичный
представитель алифатич. суль-фокислот: образует соли, сложные эфиры (мезилаты),
хлор-ангидрид-метансульфохлорид. При нагр. Ag-соли М. с метансульфохлоридом
при 160 °С или М. с Р2О5 образуется ангидрид М. (CH3SO2)2O.
При сплавлении с КОН М. разлагается
с выделением Н2 и образованием К-солей угольной и сернистой к-т.
М. присоединяется по кратным
связям ацетиленов, алле-нов и кетенов: R2C=C=O + CH3SO3H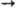 R2CHС(O)SO2CH3.
Электрохим. фторирование М. приводит к трифторметан-сульфокислоте.
R2CHС(O)SO2CH3.
Электрохим. фторирование М. приводит к трифторметан-сульфокислоте.
М. используют в орг. синтезе
для снятия бензильной защиты с амидов карбоновых и сульфокислот, напр.: n-CH3C6H4SO2N(CH3)CH2Ph n-CH3C6H4SO2NHCH3.
n-CH3C6H4SO2NHCH3.
М. получают электрохим.
окислением диметилдисульфи-да CH3SSCH3 на Pt-аноде, окислением
метантиола или диметилдисульфида (окислители-HNO3, KMnO4,
ДМСО, К2Сr2О7 и др.) либо окислением метилтиоцианата
HNO3:
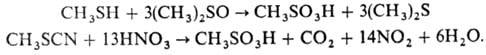
Используют также восстановление
трихлорметансульфокис-лоты электрохимически или действием амальгамы Na или Zn.
М.-катализатор этерификации,
р-ритель при получении надкислот из нер-римых в воде карбоновых к-т, катализатор
расщепления сложных эфиров, в пром-сти применяют в качестве катализатора при
получении ненасыщ. димеров a-метилстирола.
М. раздражает слизистые
оболочки, обжигает кожу.
Лит.: Сьютер Ч.,
Химия органических соединений серы, пер. с англ., ч. 1, М., 1950, с. 114;Физер
Л., Физер М., Реагенты для органического синтеза, пер. с англ.. М., 1970-78,
т. 2, с. 248^49; т. 5, с. 286; Kirk-Othmer encyclopedia, 3 ed., v. 22, N. Y.,
1983, p. 45. А. А. Дудинов.


