МУТАРОТАЦИЯ (от
лат. muto-изменяю и rotatio - вращение), самопроизвольное изменение величины
оптич. вращения свежеприготовленных р-ров оптически активных соединений. Характерна
для моносахаридов, восстанавливающих олигосахаридов, лактонов и др. Катализируется
к-тами и основаниями.
В случае глюкозы М. объясняется
установлением равновесия:
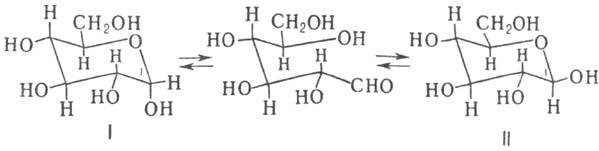
В равновесном состоянии
присутствует 38% a-формы (ф-ла I) и 62% b-формы (II). Промежут. альдегидная
форма содержится в ничтожно малой концентрации. Преимуществ, образование b-формы
объясняется тем, что гидроксил при С-1 занимает экваториальное положение.
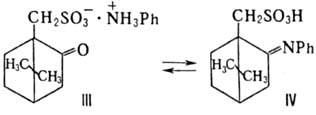
М. соед. III ([a]D
+ 37,5°) объясняется его дегидратацией в р-ре хлороформа в кетимин IV ([a]D
—170,5°). Величина вращения равновесной смеси +10,5° ;
М. аминовинилкетонов, полученных
на основе оптически активных
аминов  ,
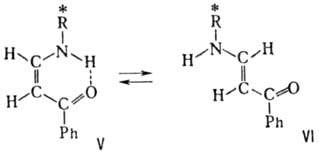
обусловлена цис,транс-изомерта-цией под влиянием р-рителя: в гептане
преобладает цис-форма V, в спирте-транс-форма VI:
,
обусловлена цис,транс-изомерта-цией под влиянием р-рителя: в гептане
преобладает цис-форма V, в спирте-транс-форма VI:
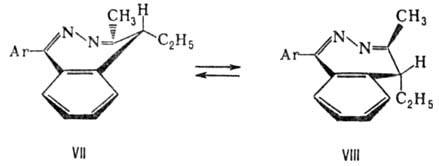
M. производных диазепина
объясняется инверсией находящегося в форме ванны (VII) азотсодержащего кольца
в кресловидную конформацию (VIII):
Явление открыто в 1846
О. П. Дюбрёнфо, названо в 1899 мутаротацией Т. М. Лоури.
Лит.: Илиел Э.,
Стереохимия соединений углерода, пер. с англ., М., 1965, c. 44-46; Степаненко
Б.Н., Химия и биохимия углеводов, М., 1977, с. 61-72; Потапов В. М., Стереохимия,
2 изд., М., 1988. В. М. Демьянович.


