НАТРИЯ БОРОГИДРИД (тетрагидридоборат
натрия) NaBH4, бесцв. кристаллы с кубич. гранецентрир. решеткой (а
= 0,6164 нм, z = 4, пространств. группа Fm3m); ниже
— 80 °С переходит
в тетрагон. модификацию (а = 0,4354 нм, с = 0,5907 нм); т. пл.
505 °С (с разл.); плотн. 1,074 г/см3; С0р
2,3 кДжДкг•К); DH0обр - 190 кДж/моль, DG0298
— 119,5 кДж/моль;
S0298 101,4 ДжДмоль • К). Хорошо раств. в полярных
р-рителях, не раств. в диэтиловом эфире, диок-сане, углеводородах; р-римость
(г в 100 г): в воде-40,6 (0°С), 56 (25 °С), в жидком NH3-99
(-22,5 °С), гидразине-25,4 (25 °С), ТГФ - менее 0,1, ДМСО - 5,8 (25
°С), ДМФА -18, этаноле-4,0 (20 °С, с медленным разложением). В водных
р-рах Н. б. постепенно гидролизуется, образуя Na3BO3 и
Н2, в щелочных р-рах гидролиз замедляется, в кислых - значительно
ускоряется; в присут. орг. к-т, солей переходных металлов скорость гидролиза
резко увеличивается. Из воды ниже 36,3 °С Н. б. кристаллизуется в виде дигидрата
NaBH4-2H2O, выше этой т-ры-в виде безводной соли. В системе
NaBH4-NH3 образуются аммиакаты NaBH4.nNH3,
где п = 3, 4, 5, конгруэнтно плавящиеся соотв. при —16 и —
20,6 °С. Гидразин, ДМФА, пиридин также образуют с Н. б. сольваты.
По хим. св-вам Н. б.-типичный
представитель борогид-ридов металлов. Окисление Н. б. на воздухе начинается
при 300 °С, при этом образуются вода и NaBO2. Кристаллический
Н. б. с хлоридами металлов в зависимости от их природы взаимод. с образованием
соответствующего боро-гидрида или диборана и металла (или гидрида) либо борида.
В неводных р-рителях Н. б. реагирует с галогенидами металлов I, II, III гр.
и лантаноидов с образованием борогидри-дов; борогидриды переходных металлов
образуются в присут. комплексообразователя (напр., R3P).
Получают Н. б. взаимод.
NaH или Na и Н2 с разл. соед. В:
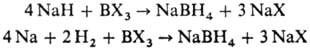
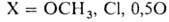
Др. группа способов основана
на использовании диборана, напр.:
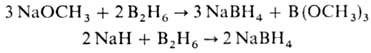
Н. б. используют как селективный
восстановитель в орг. (для восстановления групп С=О, C=N, NO2, напр.
при пром. произ-ве антибиотиков, витаминов, стeроидных препаратов) и неорг.
синтезе, для получения бороводородов, борогидридов и гидридов др. металлов,
катализаторов гид-рирования, для нанесения металлич. покрытий на разл. пов-сти
из водных р-ров, как порообразователь для пластиков.
Н. б. токсичен при приеме
внутрь, раздражает кожу. Особенно опасна пыль Н.б. Раздражают кожу также р-ры
Н.б. в жидком NH3, аминах и др.
Лит.: Жигач А.Ф.,
Стасиневич Д.С., Химия гидридов, Л.. 1969; Мальцева Н.Н., Хаип B.C., Борогидрид
натрия, М., 1985.
А. И. Горбунов, П. А.
Стороженко.


