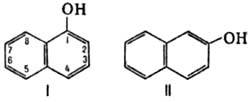
НАФТОЛЫ, мол. м.
144,16. 1-H. (a-Н., ф-ла I) и 2-Н. (b-Н., II)-бесцв. кристаллы (см. табл.) со
слабым фенольным запахом; хорошо раств. в этаноле, диэтиловом эфире, хлороформе,
бензоле, плохо-в воде.
По хим. св-вам - типичные
фенолы. С водными р-рами щелочей образуют р-римые в воде соли.
С ангидридами и хлорангидридами орг. к-т дают ацетильные производные, со спиртами
в присут. НСl или Н2SО4-эфиры, напр. метиловый эфир 2-Н.
("яра-яра"), т. пл. 72-73 °С, т. кип. 274 °С; эфиры раств.
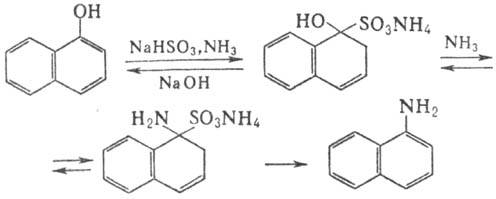
в этаноле, не раств. в воде. При нагр. с NaHSO3 и NH3
H. образуют бисульфитные производные, к-рые с избытком NH3 превращ.
в нафтиламины (р-ция Бухерера-Лепти), напр.:
Н. легко вступают в р-ции
электроф. замещения. При галогенировании под действием NaClO 1-H. образует 2-хлор-1-нафтол,
а 2-Н.-1-хлор-2-нафтол, под действием SO2Cl2 соотв.-4-хлор-1-нафтол
и 1,4-дихлор-2-нафтол. При сульфировании 98%-ной H2SO4
1-H. превращ. в 1-гидрокси-нафталин-2-сульфокислоту с примесью 4-гидроксинафта-лин-1-сульфокислоты,
с 2 молями H2SO4 образует 4-гидро-ксинафталин-1,3-дисульфокислоту.
2-Н. при сульфировании при 0°С превращ. сначала в 3-гидроксинафталин-1-сульфо-кислоту,
с 10 эквивалентами Н2SО4-в 3-гидроксинафта-лин-1,4-дисульфокислоту;
повышение т-ры р-ции приводит к смеси сульфокислот.
При нитровании 1-Н. 65%-ной
HNO3 в СН3СООН нитро-группа вступает в положение 2, в
СНСl3-в положения 2 и 4. При нитровании 2-Н. под действием NO2
нитрогруппа сначала вступает в положение 1, а затем в 6. С диазосоеди-нениями
1-Н. сочетается по положению 4, а затем 2, 2-Н.-по положению 1. Гидрирование
1- и 2-Н. в кислой среде в присут. Pt (70 °С, 0,3 МПа) приводит соотв. к
5- и 6-ги-дрокситетралинам, в щелочной среде в присут. Ni или Pd/C (60-70°С,
1,2-1,4 МПа)-к 1- и 2-гидрокситетра-линам.
Сухие Na-соли Н. подобно
фенолятам реагируют с СО2 с образованием гидроксикарбоновых к-т.
Так, 1-Н. при 170°С превращ. в 1-гидроксинафталин-2-карбоновую к-ту, а 2-Н.
при 130°С-в 2-гидроксинафталин-1-карбоновую к-ту; последняя при 200-250
°С перегруппировывается в 3-гидрокси-нафталин-2-карбоновую к-ту.
НЕКОТОРЫЕ СВОЙСТВА НАФТОЛОВ

* Двойное лучепреломление.
1-Н. получают гидролизом
1-нафтиламина или 5-амино-нафталин-1-сульфокислоты под действием 20%-ной H2SO4
при 185-240 °С под давлением (выход 69-73%), взаимод. 1-нафтиламина
с NaHSO3 и NaOH, сплавлением Na-соли нафталин-1-сульфокислоты с NaOH
при 300 °С (выход 93%), а также окислением тетралина О2 или воздухом
при 100-130 °С (кат. - МоО2) с послед. дегидрированием в присут.
Ni при 200-400 °С.
2-Н. получают щелочным
плавлением нафталин-2-суль-фокислоты при 300-315 °С (выход 70-82%), окислением
1-изопропил-2-нафтиламина О2 или воздухом при 110°С (кат.-стеарат
Na, NaOH или МпО2) с послед. гидролизом, а также гидролизом 2-хлорнафталина
водой (кат. - CuO/SiO2, 270-290 °С).
Н.-промежут. продукты в
синтезе азокрасителей. 1-Н.-исходное в-во для получения 1-гидроксинафталин-2-карбо-новой
к-ты, 1-нафтилмочевины (зооцид). 2-Н.-исходное в-во в произ-ве 2-гидроксинафталин-3-карбоновой
к-ты, 2-гидро-ксинафталинсульфокислот, 2-нафтиламина и 2-фенилнафти-ламина,
сильный антисептик, антиоксидант скипидара и каучуков; этиловый эфир 2-Н. (неролин,
или бромелия)-душистое в-во в парфюмерии. Смесь 2-Н. с тринитро-бензолом, тринитротолуолом
и динитрохлорбензолом-фунгицид. Для 2-Н. т. всп. 153°С, ПДК 0,1 мг/м3.
Лит.: Доналдсон
Н., Химия и технология соединений нафталинового ряда, пер. с англ., М., 1963,
с. 302-27. Я. Б. Карпова.


