НИКЕЛЬОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ,
содержат связь Ni—С. Связь Ni с орг. лигандом может осуществляться по s-
и p-типу (соотв. s- и p-комплексы).
s-К о м п л е к с ы. Соед.
Ni с s-связью Ni—С относятся в осн. к типам [Ni(R2)L2]
и [NiX(R)L2] (R = Alk или Аr, L = PR'3, амины и
др., Х-ацидолиганд), имеющим строение плоского квадрата С транс-расположением
лигандов (см. Координационные соединения). Для них характерны р-ции обмена
ацидо- и донорных лигандов с сохранением связи Ni—С, а также р-ции замещения
группы R и р-ции внедрения СО и алкинов по связи Ni—С. Соед. [Ni (acac)(R)L]
(R = Alk, асас-ацетилацетонат-анион) обычно получают восстановлением
Ni(acac)2 с помощью орг. соед. Аl в присут. PR3;
они также образуются при взаимод. [Ni (acac)(Н)L] с алкенами. Эту р-цию
рассматривают как первую стадию димеризации алкенов в присут, гидридов Ni. Бинарные
Н, с. типа [NiR2]
крайне неустойчивы, их удается выделить только для соед. с объемным R при отсутствии
в R b-атомов Н, как, напр., в бис-(мезитил)никеле; известны перфторалкиль-ные
Н.с., напр. [Ni(C6F5)2]. Присоединение карбаниона
к [NiR2] приводит к солеобразным комплексам (никелат-комплексам)
[NiR4]2-, напр. K2[Ni(C=CR)4],
[N(C4H9)4]2 x х [Ni(C6H5)4].
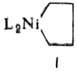
К соед. с s-связью Ni—С относятся также никелациклопeнтановые комплексы (ф-ла
I)-промежут. соед. при димеризации напряженных алкенов.
p-К о м п л е к с ы. Алкеновые
и полиеновые Н.с., содержащие
Ni в нулевой степени окисления, имеют тригональную или
тетраэдрич. структуру. Эти соед. весьма чувствительны к действию
О2 воздуха; вступают в р-ции окислит. присоединения
и обмена лигандов. Восстановлением соли Ni орг. соед. Аl
в присут. 1,5,9-циклододекатриена (cdt)получен тригон. комплекс [Ni(cdt)],
имеющий транс, транс, транс-конфигурацию. Это Н.с.-исходное в-во для
синтеза неустойчивых олефиновых комплексов, напр.:
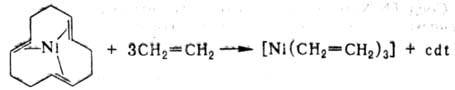
Известны также h2-алкеновые
комплексы [NiL2(алкен)], стабилизированные донорными лигандами (о
значении символа h см. Гапто-). Их получают замещением алкена на донорный
лиганд или замещением донорного лиганда на алкен, напр.:
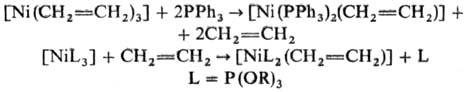
Из тетраэдрич. комплексов
Ni наиб. важен бис-(1,5-цикло-октадиен)никель [Ni(cod)2],
к-рый широко используется как реагент в химии Н.с. и в орг. синтезе. Известно
также большое число комплексов Ni, содержащих a,b-нена-сыщ. альдегиды и кетоны,
сложные эфиры, нитрилы, пер-фторалкены, дурохинон (тетраметил-1,4-бензохинон).
Среди них - бис-(акрилонитрил)никель, получаемый р-цией [Ni(CO)4]
с CH2=CHCN, к-рому приписывают полимерное строение.
Никель образует h2-алкиновые
комплексы. Осн. тип моноядерных комплексов- [NiL2(RC=CR)],
имеющих плоское тригон. строение. Их получают замещением нек-рых лигандов в
Н.с. на алкин, напр.:
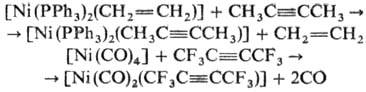
В биядерных и кластерных
комплексах Ni молекула ал-кина часто играет роль мостикового лиганда, напр.:
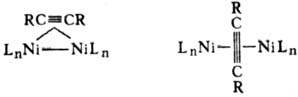
Подробно изучены h3-аллильные
комплексы [Ni(h3-ал-лил)2]. Эти соед. чрезвычайно чувствительны
к действию О2 воздуха, в присут. к-рого самовозгораются. Для них
характерны h3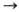 h1-перегруппировки,
протекающие под действием донорных лигандов:
h1-перегруппировки,
протекающие под действием донорных лигандов:
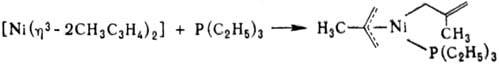
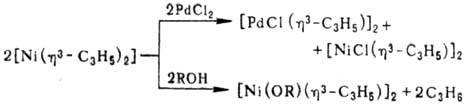
При взаимод. с избытком
донорного лиганда аллильные группы полностью замещаются, при р-ции со спиртами
и галогеноводородами возможно замещение одного аллиль-ного лиганда, в р-циях
с Fc2(CO)9 или PdCl2 происходит перенос h3-аллильной
группы с Ni на др. металлы, напр.:
Соед. [Ni(h3-аллил)2]
получают р-цией NiHal2 с ал-лилмагнийгалогенидами или диспропорционированием
[{NiХ(h3-аллил)}2] под действием координирующих р-рителей
(NH3, ДМФА, Н2О и др.):
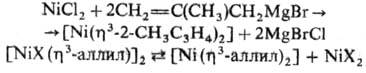
Соед. [NiХ(h3-аллил)]2
м. б. получены окислит. присоединением аллильных производных к комплексам Ni(0),
напр.:
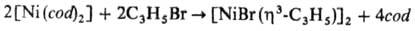
При взаимод. [Ni(cdt)]
с 1,3-бутадиеном образуется бисал-лильное Н. с.:
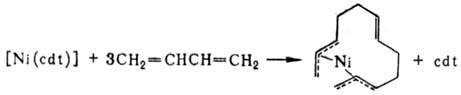
Образующийся в р-ции [Ni(h3,h3-C12Hl8)]
может реагировать далее с донорным лигандом с замыканием цикла, давая [NiL(cdt)].
Аналогично протекает р-ция [Ni(cod)2] с бутадиеном в присут.
донорных лигандов:
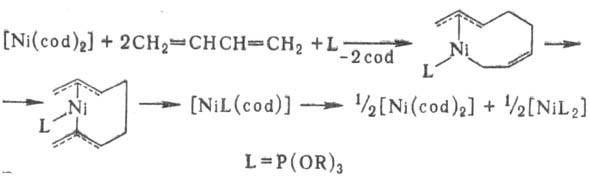
Эти р-ции рассматривают
как модельные для изучения каталитич. циклоолигомеризации диенов на комплексах
Ni(0).
Для комплексов Ni с циклобутадиеном
характерны р-ции с нуклеоф. реагентами с образованием h3-циклобутениль-ных
комплексов, перенос циклобутадиенового комплекса с Ni на др. металлы при взаимод.
с карбонилами металлов; возможно также восстановление комплексов Ni(II) до комплексов
Ni(0) в присут. донорных лигандов:
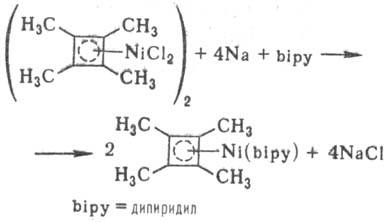
Получают циклобутадиеновые
комплексы дегалогениро-ванием 3,4-дигалогенопроизводных тетразамещенного цик-лобутена
в присут. [Ni(CO)4], переносом циклобутадиенового лиганда с Pd на
Ni, а также р-циями NiHal2 с алкинами.
Из циклопентадиенильных
комплексов Ni наиб. важен кристаллич. никелоцен [Ni(h-C5H5)2],
постепенно разлагающийся на воздухе; парамагнитен. Для него характерны р-ции
по связям металл-цикл (напр., при действии восстановителей, оснований и к-т),
р-ции замещения и присоединения в одном из циклов, напр.:
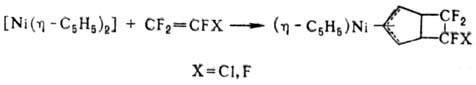
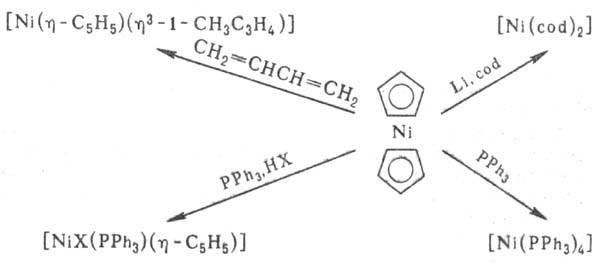
Никелоцен легко окисляется
в р-рах до монокатиона [Ni(h-C5H5)2]+;
электрохимически можно получить ступенчато моно- и дикатионы. Никелоцен - исходное
в-во практически для всех моноциклопентадиенильных комплексов Ni:
Осн. способ получения никелоцена-
р-ция солей Ni с циклопентадиенидами щелочных металлов или Тl.
h-Ареновые комплексы нетипичны
для Ni. Наиб. изучен комплекс [Ni{h-C6(CH3)6}2]2+(AlBr4)2,
образующийся при взаимод. NiBr2 с гексаметилбензрлом в присут. АlВr3.
Соконденсацией в паровой фазе Ni со смесью бромпента-фторбензол-толуол синтезирован
[Ni(C6F5)2(h-CH3C6H5)].
Н.с. широко применяют в
гомогенном и гетерогенном катализе. Так, алкеновые и полиеновые комплексы Ni(0)-эффективные
катализаторы линейной олигомеризации и гидросилилирования олефинов, циклоолигомеризации
и изомеризации диенов; аллильные Н.с. вызывают цикло-олигомеризацию бутадиена,
а в присут. добавок (фосфины, орг. соед. Аl)-линейную олигомеризацию ненасыщ.
углеводородов. бис-(Аллил)никель на SiО2-кат. гидрирования
и полимеризации бутадиена. Нек-рые Н.с., напр. [Ni(cod)2]
и [Ni(h-C5H5)2], используют для получения металлич.
покрытий.
Лит.: Методы элементоорганической
химии. Кобальт, никель, платиновые металлы, под общ. ред. А. Н. Несмеянова,
К. А. Кочешкова, М., 1978, с. 128-245; Jolly P. W., Nickel, в кн.: Comprehensive
organometallic chemistry, ed. by G. Wilkinson, v. 6, Oxf., 1982. Л. С. Исаева.


