ОЗОНИДЫ НЕОРГАНИЧЕСКИЕ,
ярко-красные твердые соед. общей ф-лы М(О3)n, где п
заряд катиона М. Ион О-3 имеет симметричную треугольную
конфигурацию; в молекуле RbO3 длина связи О—О 0,134 нм, угол ООО
114°, в молекуле [(CH3)4N]O3 длина связи
О—О 0,1286 нм, угол ООО 119,5°. Все озониды (О.) парамагнитны, термически
малостабильны. Стабильность наиб. устойчивых О. убывает в ряду [(CH4)3N]O3
> CsO3 > RbO3 > КО3 (см. табл.). О.
щел.-зем. металлов распадаются в интервале от - 30 до О °С. О. лития, известный
только в виде аммиаката [Li(NH3)4]O3, неустойчив
уже при -78 °С; NH4O3 устойчив ниже -126°С. О.
магния, серебра и др. металлов идентифицированы методом матричной изоляции в
твердом Аг или N2. Первичные продукты распада О.-супероксиды, р-ция
МО3 МО2 + 1/2 О2 экзотермична.
МО2 + 1/2 О2 экзотермична.
О. гигроскопичны и бурно
реагируют с водой с образованием О2 и щелочного р-ра Н2О2;
при этом промежуточно образуются своб. радикалы ОН* в высокой концентрации.
С парами воды р-ция идет медленнее - при 50%-ной влажности и 24 °С КО3
полностью гидролизустся за 30 ч. В присут. водяных паров КО3 количественно
реагирует с СО2, образуя К2СО3 и выделяя кислород.
О.-активные окислители; взаимод. с большинством орг. р-рителей. В инертных и
неполярных средах, напр. хладонах, О. не раств.; хорошо раств. в жидком NH3,
на чем основан метод их выделения и очистки.
Получают О. действием О3 на гидроксиды или супероксиды металлов в среде хладона или в кипящем слое. Тонкий слой О., образовавшийся на пов-сти кристаллов исходного в-ва, экстрагируют жидким NH3, после чего р-ритель упаривают. О. щелочных металлов могли бы быть эффективными ср-вами регенерации О2 и высокоемкими кислородоносителями, но из-за низкой их термич. стабильности и трудной доступности практич. применения не нашли.
СВОЙСТВА ОЗОНИДОВ ЩЕЛОЧНЫХ
МЕТАЛЛОВ
|
Показатель |
NaO3 |
К03 |
RbO3 |
Cs03 |
||
|
Сингония |
Тетрагон. |
Тетрагон. |
Моноклинная |
Моноклинная* |
||
|
Пространств. группа |
14/ттт |
I4/тст |
Р21/с |
Р21/c |
||
|
Рентгеновская плотн.,
г/см3 |
|
2,16 |
3,08 |
3,65 |
||
|
|
-193 |
-261 |
-264 |
-271 |
||
|
Т. разл., °С |
-10 |
60 |
70 |
80 |
||
|
Энтальпия р-ции
МO3 кДж/моль |
-67 |
-22 |
-15 |
-15 |
||
|
Р-римость в жидком
NH3, г в 100 г |
- |
14,8 (-35°С) |
4,3 (-82°С) |
|
||
* Устойчива ниже 8°С,
выше 8 °С - кубическая.
Лит.: Токарева С.
А., "Успехи химии", 1971, т. 40, в. 2, с. 295-311.
В. Я. Росоловский.



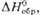 кДж/моль
кДж/моль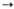 МO2 +
МO2 + 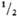 О2,
О2,