ОКСИКИСЛОТЫ (гидроксикарбоновые
к-ты, гидроксикис-лоты), содержат в молекуле карбоксильную и гидроксиль-ную
группы. В статье рассмотрены алифатические О. (см. также Оксибензойные кислоты
и Оксинафтойные кислоты). В зависимости от взаимного расположения
групп ОН и СООН различают 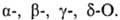 Число групп СООН определяет основность О., а число групп ОН (включая ОН в СООН)-их
атомность. Мн. природные О. содержат один или неск. асимметрич. атомов С и существуют
в виде оптич. изомеров.
Число групп СООН определяет основность О., а число групп ОН (включая ОН в СООН)-их
атомность. Мн. природные О. содержат один или неск. асимметрич. атомов С и существуют
в виде оптич. изомеров.
О. широко распространены
в природе, их остатки входят в состав сфинголипидов животных и растений.
О.- кристаллич. в-ва, низшие
О. из-за сильной гигроскопичности - густые сиропообразные жидкости, хорошо раств.
в воде. Физ. св-ва нек-рых О. представлены в таблице. О. вступают в р-ции, характерные
для карбоновых к-т и спиртов, обладают также специфич. св-вами. Они более сильные
к-ты, чем соответствующие карбоновые. Это объясняется существованием внутримол.
водородной связи между группами ОН и СООН в 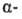 и
и
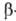 -О.; более
сильную водородную связь образует карбоксилат-анион, получающийся при диссоциации
О. Повышению кислотности способствует также индуктивный эффект группы ОН.
-О.; более
сильную водородную связь образует карбоксилат-анион, получающийся при диссоциации
О. Повышению кислотности способствует также индуктивный эффект группы ОН. 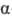 -О.
при нагр. дегидрати-руются с образованием лактидов;
-О.
при нагр. дегидрати-руются с образованием лактидов;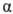 -О.
с третичной группой ОН при нагр. образуют кетоны и
-О.
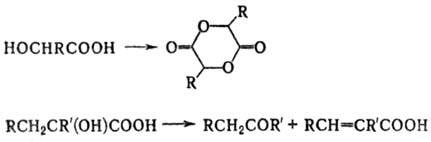
с третичной группой ОН при нагр. образуют кетоны и 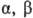 -непредельные
к-ты, а при окислении (КМnО4, Н2СrO4 и др.)-кетоны,
напр.:
-непредельные
к-ты, а при окислении (КМnО4, Н2СrO4 и др.)-кетоны,
напр.:
С солями нек-рых металлов,
напр. Fe(III), Cu(II), -О.
дают комплексы.
-О.
дают комплексы.
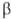 -О. при нагр. или при действии к-т дегидратируются с образованием
-О. при нагр. или при действии к-т дегидратируются с образованием 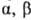 -ненасыщ.
к-т, в присут. основных катализаторов претерпевают ретроальдольное разложение,
напр.:
-ненасыщ.
к-т, в присут. основных катализаторов претерпевают ретроальдольное разложение,
напр.:
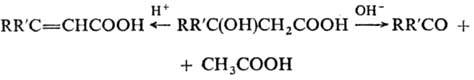
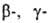 и
и 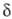 -О. при
нагр., а также при действии водо-отнимающих агентов [(СН3СО)2О,
СОСl2, карбодиимиды] образуют лактоны, при этом
-О. при
нагр., а также при действии водо-отнимающих агентов [(СН3СО)2О,
СОСl2, карбодиимиды] образуют лактоны, при этом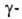 и
и
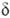 -О.-самопроизвольно:
-О.-самопроизвольно:
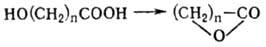
Образование лактонов с
более удаленной группой ОН (больше 7 атомов С в молекуле) затруднено; их получают
нагреванием  О.
в сильноразбавленных, р-рах, а также активированием
групп ОН и СООН с промежут. образованием активных эфиров.
О.
в сильноразбавленных, р-рах, а также активированием
групп ОН и СООН с промежут. образованием активных эфиров.
СВОЙСТВА НЕКОТОРЫХ ГИДРОКСИКИСЛОТ
|
Соединение |
Мол. м. |
Т. пл., °С |
Т. кип., °С
(мм рт. ст.) |
К·104 (25 °С) |
||
|
Гликолевая к-та
НОСН2СООН |
76,052 |
80 |
- |
1,48 |
||
|
Молочная к-та НОСН(СН3)СООН |
90,078 |
18 |
122(14) |
1,4* |
||
|
Гидракриловая к-та
НОСН2СН2СООН |
104,104 |
- |
- |
0,3** |
||
|
Ацетоновая к-та
НОС(СН3)2СООН |
То же |
82 |
114(12) |
1,1 |
||
|
|
-"— |
44 |
138(14) |
1,5* |
||
|
|
-"— |
- |
94(0,1) |
0,4 |
||
|
|
-"— |
17 |
- |
0,2 |
||
|
Глицериновая к-та
НОСH 2 СН (ОН) СООН |
106,078 |
134 |
- |
2,8 |
||
* Для рацемата. ** При
30 °С.
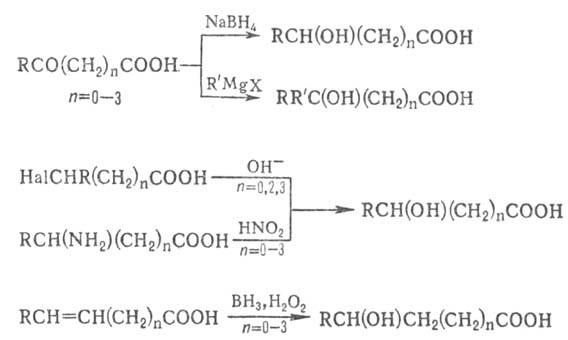
Общие методы синтеза О.:
восстановление СО-группы альдегиде- и кетокислот или их взаимод. с реактивами
Гриньяра; гидролиз галогензамещенных к-т или диазотиро-вание аминокислот; присоединение
воды к непредельным к-там, напр.:
 -О. получают также присоединением KCN или LiСОN(изо-С3Н7)2
к альдегидам или кетонам с послед, гидролизом образующихся циангидринов (гидроксинитри-лов)
или амидов
-О. получают также присоединением KCN или LiСОN(изо-С3Н7)2
к альдегидам или кетонам с послед, гидролизом образующихся циангидринов (гидроксинитри-лов)
или амидов  -О.
Для синтеза
-О.
Для синтеза  -О.
используют р-цию Реформатского, а также взаимод. дилитиевых производных карбоновых
к-т с карбонильными соед., напр.:
-О.
используют р-цию Реформатского, а также взаимод. дилитиевых производных карбоновых
к-т с карбонильными соед., напр.:
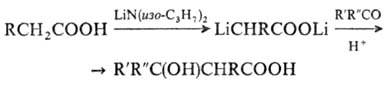
 и
и  -О. получают
окислением циклич. кетонов надкисло-тами (р-ция Байера-Виллигера) с послед.
гидролизом лактонов.
-О. получают
окислением циклич. кетонов надкисло-тами (р-ция Байера-Виллигера) с послед.
гидролизом лактонов.
О. играют важную роль в
биохим. процессах. Лимонная кислота и яблочная кислота - ключевые
продукты цикла трикарбоновых к-т;  -
и
-
и 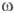 -О.-промежут.
продукты метаболизма жирных к-т, а молочная кислота - метаболизма углеводов;
мевалоновая к-та (3,5-дигидрокси-З-метилпента-новая)-промежут. продукт синтеза
стеринов.
-О.-промежут.
продукты метаболизма жирных к-т, а молочная кислота - метаболизма углеводов;
мевалоновая к-та (3,5-дигидрокси-З-метилпента-новая)-промежут. продукт синтеза
стеринов.
Из О. применение находят
глицериновая к-та и гликолевая кислота -для травления и снятия ржавчины
с металлич. покрытий, гликолевая к-та-также в качестве протравы при крашении;
гидракриловая - в синтезе эмульгаторов; ацетоновая-как добавка к полимерам для
увеличения их вязкости; 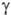 -гидроксимасляная
и ацетоновая-в синтезе лек. ср-в.
-гидроксимасляная
и ацетоновая-в синтезе лек. ср-в.
См. также Винные кислоты,
Рицинолевая кислота, Урановые кислоты.
Лит.: Общая органическая
химия, пер. с англ., т. 4, М., 1983, с. 156-95.
Д. В. Иоффе.



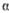 -Гидроксимасляная к-та НОСН(С2Н5)СООН
-Гидроксимасляная к-та НОСН(С2Н5)СООН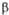 -Гидроксимасляная к-та НОСН(СН3)СН2СООН
-Гидроксимасляная к-та НОСН(СН3)СН2СООН -Гидроксимасляная к-та НО(СН2)3СООН
-Гидроксимасляная к-та НО(СН2)3СООН