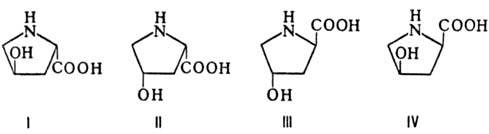
ОКСИПРОЛИН (гидроксипролин,
4-гидроксипирролидин-2-карбоновая к-та, Hyp), мол. м. 131,13; возможно существование
4 оптически активных стереоизомеров О.: L-О. (ф-ла I), алло-L-O. (II),
D-O. (III) и алло-D-O. (IV).
О.-бесцв. кристаллы; для
L-О. т. шт. 274 °С, 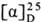 -76,5° (2,5 г в 100 мл воды), для алло-L-O.
-76,5° (2,5 г в 100 мл воды), для алло-L-O. 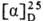 -59,5°
(2%-ный р-р в воде); раств, в воде, ограниченно - в этаноле, не раств. в диэтиловом
эфире. При 25 °С для L-О. рKa 1,92 (СООН) и 9,74 (NH2);
pI 5,83.
-59,5°
(2%-ный р-р в воде); раств, в воде, ограниченно - в этаноле, не раств. в диэтиловом
эфире. При 25 °С для L-О. рKa 1,92 (СООН) и 9,74 (NH2);
pI 5,83.
С нингидрином О. дает желтое
окрашивание, с изатином-синее. С солью Рейнеке NH4[Cr(NH3)2(SCN)4]·H2O
образует нераств. соединение. Остатки L-О. входят преим. в состав белков соединит,
ткани - коллагена (до 13%), а также эластина; алло-L-O. встречается
в своб. состоянии в цветах сандалового дерева, его остатки входят в состав токсичных
пептидов бледной поганки - фаллоидина, 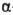 -
и
-
и 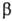 -аманитинов.
-аманитинов.
В пептидном синтезе для
защиты гидроксигруппы остатка О. применяют бензильную и трет-бутильную
группы; хим. р-ции по атому N пространственно затруднены.
L-О.-заменимая некодируемая
аминокислота, не включается в пептидную цепь при биосинтезе, а образуется при
ферментативном гидроксилировании остатков пролина. Продукты метаболизма О. в
организме - пиррол-2-карбоно-вая и глутаминовая к-ты.
Получают О. из гидролизатов
коллагена и нек-рых др. белков. Количественно О. определяют колориметрически,
используя нингидриновую р-цию или р-цию л-диметилами-нобензальдегида с пиррол-2-карбоновой
к-той, образующейся при окислении О. пероксидом водорода.
L-О. впервые выделен из
желатина Э. Фишером в 1902; L-алло-О.-из яда бледной поганки Т.
Виландом в 1940; D-алло-О- из антибиотика этамицина Дж. Шиханом
в 1958 (D-O. из прир. объектов не выделен). Мировое произ-во L-O. ОК.
50 т/год (1982). В. В. Баев.


