ОЛОВООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
(органостан-наны), содержат связь Sn—С. Наиб. распространены соед. Sn(IV), имеются
отдельные примеры соед. Sn(II). Осн. типы О.с. Sn(IV): R4Sn, R3SnX,
R2SnX2, RSnX3 (X = Hal, псевдогалоген, OH,
OR' NR'2, SR', OCOR', H, OSnR3, SnR3, металл
и др.), (R,SnO)n, (R2SnS)n, [RSnO(OH)]n
и др. Для О. с. типа R4Sn, R3Sn—SnR3, (R3Sn)2O,
оловоорг. гидридов и сульфидов, олигомерных О.с., напр. [(C4H9)2Sn(OCH3)2]2,
характерно тетраэдрич. строение с sp3-гибридизов. орбита-лями
Sn; для О. с. с более электроотрицат. заместителями -обычно тригонально-бипирамидальная
(sp3d-гибридизация) или октаэдрич. (sp3d2)структура с 5- и 6-координац. Sn. Повышение координац. числа Sn может происходить
благодаря координации с внеш. лигандом, напр. соед. ф-л I и II, внутримол. координации
(III) и самоассоциации (IV):
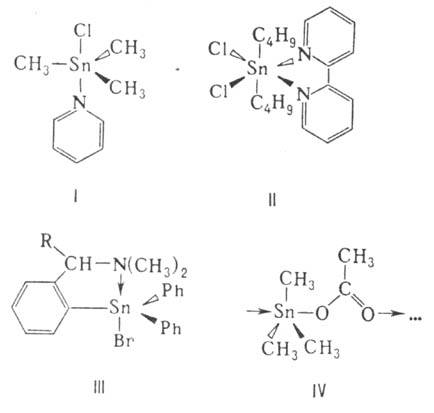
Известны комплексы О. с.
с координац. числом более 6, напр. комплекс (CH3)2Sn(NCS)2
с трипиридилом-7-коор-динационный пентагонально-бипирамидальный, комплекс PhSnCl3
с 4 молекулами морфолина-8-координационный.
Для определения структуры
О. с. используют методы ИК, УФ спектроскопии, рентгеноструктурный анализ, а
также спектроскопии ЯМР 119Sn и мёссбауэровскую, к-рые позволяют
определять координац. число Sn и взаимное расположение лигандов в О. с.
Соединения Sn(IV). О. с.
типа R4Sn-6eсцв.. жидкости (R-алкил, винил, этинил) или твердые в-ва
(R-арил), раств. в орг. р-рителях, термически стабильны (до 200 °С), относительно
устойчивы по отношению к воде и кислороду воздуха; RR'R:R'''Sn хиральны.
Для соед. этого типа характерны р-ции разрыва связи Sn—С под действием электроф.
агентов, часто с нуклеоф. содействием, напр.:
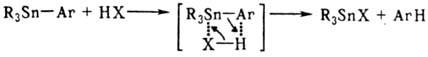
Гомолиз связи Sn—С менее
характерен, может протекать под действием Вг2,I2, N-бромсукцинимида
и др. Р-ция R4Sn с галогенидами Sn (р-ция Кочешкова) в зависимости
от соотношения реагентов и т-ры приводит к хлоридам три-, ди- и моноорганостаннанов:
при соотношении 3:1 и 200 °С образуются R3SnHal, при 1:1 и 200°C-R2SnHal2,
при 1:3 и 100°C-RSnHal3. Галогены отщепляют орг. радикал от соед.
R4Sn; легкость отщепления увеличивается в ряду: алкил < винил
< бензил < фенил. Соед., содержащие 2,3-не-насыщ. радикалы, легче подвергаются
гетеро- и гомолитич. разрыву связи Sn—С из-за ст, я-сопряжения.
В пром-сти R4Sn
получают взаимод. SnCl4 с другими металлоорг. соед., чаще всего RMgX,
при нагр. в ТГФ или толуоле:
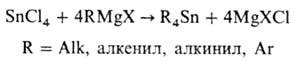
Соед. R4Sn (R
= С4Н9 и С8Н17) получают р-цией
R3Al и SnCl4 в присут. простых эфиров; (CH3)4Sn-электролизом
СН3Сl и SnCl4 в расплаве NaCl-AlCl3.
Иногда используют гидростаннилирование
(присоединение R3SnH к алкенам и алкинам), особенно для синтеза функционально
замещенных О. с.; при этом образуются (b-аддукты, напр. 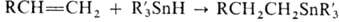 ; 1,3-диены образуют продукты 1,4-присоединения.
; 1,3-диены образуют продукты 1,4-присоединения.
О. с., содержащие циклопентадиенильный
или этинильный радикалы, а также радикалы, замещенные в а-положении на функц.
группы, получают взаимод. станниламинов с СН-кислотами, напр.:
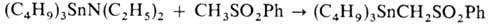
О. с. типа RnSnX4_n
(X = Hal или псевдогалоген, п = 1 — 3) - жидкие или твердые в-ва, раств.
в орг. р-рителях (кроме фторидов), соед. при R = СН3 раств. в воде.
В газовой фазе и инертных р-рителях-тетраэдрич. мономеры, в твердом виде имеют
тенденцию увеличивать координац. число атома Sn до 5 (R3SnX) или
6 (R2SnX2 и R2SnX3) благодаря ассоциации
через мостиковые атомы X. С увеличением объема R склонность к ассоциации уменьшается.
Соед. R3SnX
гидролитически устойчивы, R2SnX2 гидроли-зуются до оксидов
R2SnO [для О. с. с объемными R можно выделить промежуточные R2Sn(OH)X];
RSnX3 образуют на воздухе гидраты RSn(OH)X2 · Н2О.
Атомы X в RnSnX4
весьма подвижны и легко замещаются на атомы металлов Iа и IIа гр., водорода
(при действии LiAlH4), алкил- (при действии RMgX и др.), алкокси-,
алкилтио-, аминогруппы и др.; при взаимод. с оловоорг. гидридами образуются
несимметричные дистаннаны, напр.
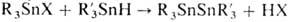 . Р-ция со щелочами приводит к оловоорг. гидроксидам, оксидам, полимерным оксидам
и органостанноновым к-там, напр.:
. Р-ция со щелочами приводит к оловоорг. гидроксидам, оксидам, полимерным оксидам
и органостанноновым к-там, напр.:
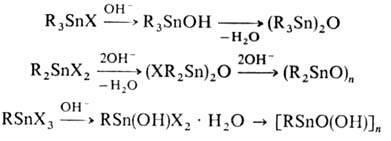
С разл. лигандами образуют комплексы R3SnX • L, R2SnX2 • L2, RSnX3 • L2.
В пром-сти соед. R4SnX4-n
получают прямыми методами из орг. галогенидов и металлич. Sn в присут. катализаторов
(напр., Ph4SbCl или Ph3Sb) либо алкилированием галогенидов
Sn магний- или литийорг. соед., напр.: SnX4+nRMgX
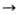 RnSnX4_n
+ nMgX2.
RnSnX4_n
+ nMgX2.
Соед. RnSnHal4-n
м. б. получены также деалкилированием R4Sn или RnSnR'4_n
при действии SnCl4 [применяется для пром. синтеза (C4H9)3SnCl,
(C4H9)2SnCl2, C8H17SnCl2
и Ph3SnCl], неорг. солей (TiCl4, AlCl3, BiCl3,
HgCl2 и др.), галогенов и галогеноводородных к-т. Органооловогалоге-ниды
образуются при действии галогеноводорода на R3SnOH, R2SnO
и RSnOOH, галогена, галогеноводорода или алкил-галогенида на оловоорг. гидриды
или галогена на О. с. со связями Sn—Sn.
Диарилоловогалогениды получают
разложением двойных солей арилдиазонийхлорида с SnCl4:
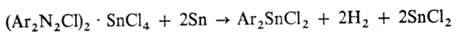
Соед. RnSnX4-n(X
= CN, SCN, N3 и др.) получают действием соответствующих к-т на R3SnOH,
(R3Sn)2O или R3SnNR2 или их солей
на RnSnCl4_n.
Кислородсодержащие оловоорг.
соединения. Гидроксиды R3SnOH-обычно твердые в-ва, обладают резким
запахом, раств. в орг. р-рителях (низшие члены ряда раств. в воде); (CH3)3SnOH
в р-ре-димер, в твердом виде-полимер. При плавлении или растворении (за исключением
R3SnOH, где R = СН3, Аr или объемный алкил) подвергаются
спонтанной обратимой дегидратации:
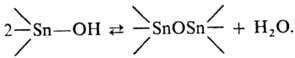
Получают гидроксиды щелочным
гидролизом R3SnX (X = Hal, OCOR', OR', NR2 и др).
Оксиды R2SnO-аморфные
твердые нерастворимые в-ва, разлагаются выше 200 °С, имеют разветвленную
полимерную структуру, их гидраты R2Sn(OH)2 нестойки; (R3Sn)2O-жидкости,
перегоняющиеся в вакууме, [(CH3)2Sn]2O в отличие
от др. оксидов с (CH3)3SnHal (Hal = Cl, Br) образует оксо-ниевые
соли [(CH3)3Sn]3O+X- ;
(Ar3Sn)2O-твердые нерастворимые в-ва. При взаимод. оксидов
Sn со спиртами или фенолами образуются алкокси(арокси)диалкилолово, с орг. или
неорг. к-тами или их солями-соответствующие производные, напр.:
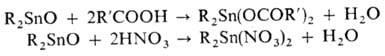
Алкоксиды-жидкости, арилоксиды-твердые
в-ва, чувствительны к влаге и СО2. Р-ция гетеролитич. присоединения
(C4H9)3SnOC2H5 с фенилизоцианатом
используется в пром. синтезе полиуретанов:
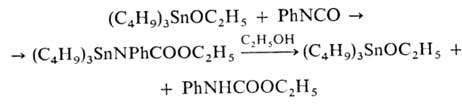
Производные неорг. к-т-обычно
твердые в-ва, реже масла, орг. к-т типа RnSn(OCOR')4_n-жидкости
или твердые в-ва. В р-ре эти соед. имеют мономерную структуру с внутримол. координацией,
в твердом состоянии-полимерную с мостиковыми карбоксилатными группами. Производные
орг. к-т при п = 3 гидролитически устойчивы, при п = 2 - частично,
а при п = 1 полностью гидролизуются, при нагр. разлагаются с выделением
СО2. Получают произ-, водные орг. и неорг. к-т взаимод. их солей
с оловоорг. хлоридами, действием орг. к-т или их ртутных солей на R4Sn,
внедрением SO3 или SO2 по связи Sn—С в R4Sn,
р-цией органооловооксидов с СО2.
Органостанноновые к-ты
RSn(O)OH-aмфoтcpныe неплавкие в-ва с т-рой разл. >300°С, плохо раств.
в орг. р-рителях, не раств. в воде, имеют, по-видимому, полимерную
структуру. С галогеноводородами образуют тригало-гениды алкилолова RSnHal3,
со спиртами-соед. RSn(OR')3, с аминоспиртами образуются станнатраны,
напр.:
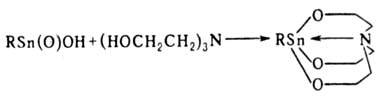
Известны 3 типа оловоорг.
пероксидов: R3SnOOR', R3SnOOSnR3 и R3SnOOH.
Алкоксипероксиды наиб, стабильны и охарактеризованы. Получают пероксиды замещением
галогена в галогенидах Sn на пероксидную группу, напр.:
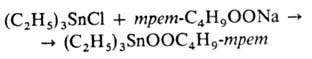
Оловоорг. гидриды RnSnH4-n
(п = 1 — 3), как правило,-перегоняющиеся жидкости (СН3SnН3-газ),
раств. в орг. р-рителях; мономерны; медленно разлагаются даже при комнатной
т-ре, устойчивость возрастает с увеличением числа алкильных групп. Вступают
в гетеролитич. и гомоли-тич. р-ции. Оловоорг. гидриды легко замещают водород
при взаимод. с др. металлоорг. соед., гидридами металлов Iа гр., реактивами
Гриньяра и к-тами; р-цию с Сl2СНСООН используют для их количеств,
определения: R3SnH + + Сl2СНСООН 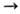 R3SnOC(O)CHCl2 + Н2. Мн. р-ции оловогидридов
по кратным связям протекают гетеролити-чески, при наличии электроноакцепторных
заместителей или в присут. катализаторов м. б. гомолитическими; с сопряжен ными
кратными связями образуют продукты 1,4-присоеди нения, напр.:
R3SnOC(O)CHCl2 + Н2. Мн. р-ции оловогидридов
по кратным связям протекают гетеролити-чески, при наличии электроноакцепторных
заместителей или в присут. катализаторов м. б. гомолитическими; с сопряжен ными
кратными связями образуют продукты 1,4-присоеди нения, напр.:
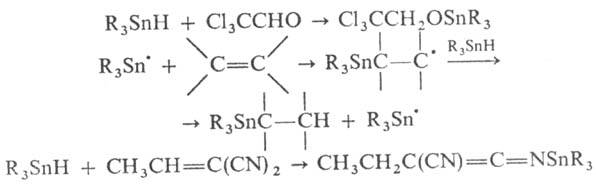
Получают R4SnH4_n
восстановлением галогенидов Sn LiAlH4 или SiH4.
О. с. со связью Sn — N.
Известны 3 типа соед.: ами-ностаннаны RnSn(NR'2)4_n,
станниламины (R3Sn)nNR'3-n, станназаны
(R2Sn=NR')n- Соед. [(CH3)3Sn]3N
имеет плоскую структуру, [(СН3)2Sn=НС2Н5]3-циклич.
тример.
Аминостаннаны вступают
в р-ции присоединения и заме щения, реагируют с СН-кислотами, напр.:
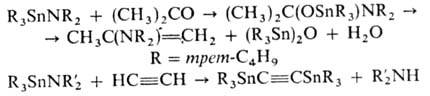
С аминами происходит трансаминирование
с образованием станниламинов: (CH3)3SnN(CH3)2
+ C2H5NH2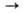
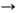 [(CH3)3Sn]2N(C2H5)2.
Получают аминостаннаны нуклеоф. замещением галогена в оловогалогенидах или присоединением
О. с. со связью Sn—Х(Х = Н, OR, OSnR3, NR2) по связи C=N,
напр.:
[(CH3)3Sn]2N(C2H5)2.
Получают аминостаннаны нуклеоф. замещением галогена в оловогалогенидах или присоединением
О. с. со связью Sn—Х(Х = Н, OR, OSnR3, NR2) по связи C=N,
напр.:
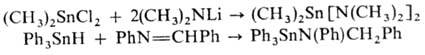
О.с. со связью Sn — Sn.
Низшие алифатич. гекса-алкилдистаннаны R3SnSnR3-6eсцв.
перегоняющиеся жидкости, устойчивые в отсутствие О2; высшие алифатич.
и ароматич. соед.-твердые высокоплавкие в-ва. Известны циклич. олигомерные полистаннаны
(R2Sn)n; мономерные диорганостанилены R2Sn
существуют лишь как интерме-диаты.
Связь Sn—Sn в R3SnSnR3
легко расщепляется галогенами, S, О2, галогенидами Ng и Bi, щелочными
металлами и их амидами, нек-рыми орг. галогенидами. Во всех случаях образуются
соответствующие производные типа R3SnY (Y = галоген, металл) или
(R3Sn)2Z (Z = O,S). Циклич. полистаннаны реагируют с размыканием
цикла, напр. (R2Sn)4 +I2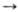 R2SnI2 , где R = трет-С4Н9.
При облучении и в присут. инициаторов происходит гомолиз связи Sn—Sn с образованием
радикалов R3Sn* или Ar3Sn* ; последние стабильны при обычных
т-рах и находятся в равновесии с Ar3SnSnAr3. Оловоорг.
радикалы - интермедиаты мн. гомо-литич. р-ций О. с.
R2SnI2 , где R = трет-С4Н9.
При облучении и в присут. инициаторов происходит гомолиз связи Sn—Sn с образованием
радикалов R3Sn* или Ar3Sn* ; последние стабильны при обычных
т-рах и находятся в равновесии с Ar3SnSnAr3. Оловоорг.
радикалы - интермедиаты мн. гомо-литич. р-ций О. с.
Гексаалкил- и гексаарилдистаннаны
получают из соответствующих галогенидов, напр.: 2R3SnBr + Na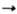 R3SnSnR3; Ph3SnBr + Ph3SnLi
R3SnSnR3; Ph3SnBr + Ph3SnLi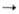 Ph3SnSnPh3;
циклич. (R2Sn)n -действием оснований на R2SnH2.
Ph3SnSnPh3;
циклич. (R2Sn)n -действием оснований на R2SnH2.
О. с. со связями Sn —S,
Sn — Se, Sn — Те. Наиб. изучены сульфиды типов (R2SnS)n,
(R3Sn)2S, R3SnSR', R2Sn(SR')2,
RSn(SR')3.
Соед. (R2SnS)n-обычно
твердые в-ва с четкими т-рами плавления, имеют структуру ди- и тримеров с 4-координац.
Sn. Известны также трисульфиды (RSnS)2S-нерастворимые в-ва, при высокой
т-ре разлагаются не плавясь. Сульфиды Sn по св-вам сходны с соответствующими
оксидами, хотя и менее реакционноспособны: труднее гидролизуются в нейтральной
среде, не присоединяются к кратным связям. О. с. со связями Sn—Se, Sn—Те менее
изучены.
Получают сульфиды, селениды
и теллуриды взаимод. оловогалогенидов с соответствующими производными щелочных
металлов или внедрением S или Те по связям Sn—Sn
или Sn—Li, напр.: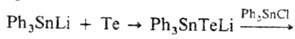
Соединения Sn(II). В
этих соед. атом Sn имеет sp2-гибридизацию. Известны соед.
типа R2Sn [R - циклопентадме-нил(Ср), [(CH3)3Si]2CH
и др.]. Соед. Ср2Sn-бесцв. кристаллы, т. пл. 105°С, две гибридные
орбнтали атома Sn служат для образования p-связи с циклопентадиеновым кольцом,
на третьей орбитали находится неподеленная пара электронов. Соед. [(CH3)3Si]2CHSnCH
[Si(CH3)3]2 -красные кристаллы, т. пл. 137°С,
в р-ре - мономер, в твердом виде-димер, связь Sn—Sn носит частично двоесвязан-ный
характер. Известно также соед. CpSnCl, бесцв. кристаллы, т. пл. 160°С, имеет
структуру с мостиковыми атомами С1.
Соед. R2Sn (R
= Alk)-сильные восстановители (окисляются О2 воздуха до оксидов
Alk2SnO, выделяют Ag из AgNO3 и Hg из сулемы), при нагр.
выделяют металлич. Sn и переходят в О. с. Sn(IV); Cp2Sn при действии
НХ (X = OR', CN и др.) образует SnX2, с SnCl2 при облучении
дает CpSnCl, с СН3I-соед. Sn(IV) CH3Cp2SnI.
О. с. Sn(II) получают при
действии металлоорг. соед. на SnCl2, напр. 2RLi + SnCl2
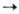 R2Sn
+ 2LiCl (R = Cp и др.) или при фотолизе (R2Sn)n.
Оловодиалкилы м. б. получены дегалогенированием R,SnCl2 Zn, амальгамой
Na или Na в жидком NH3, напр.(С2Н5)2SnСl2+
Zn
R2Sn
+ 2LiCl (R = Cp и др.) или при фотолизе (R2Sn)n.
Оловодиалкилы м. б. получены дегалогенированием R,SnCl2 Zn, амальгамой
Na или Na в жидком NH3, напр.(С2Н5)2SnСl2+
Zn 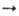 (C2H5),Sn
+ + ZnCl2.
(C2H5),Sn
+ + ZnCl2.
Применение. О. с.
применяют в пром-сти и с. х-вс. Так, дибутилоловодилаурат - стабилизатор ПВХ,
катализатор в произ-ве полиуретановых пен; (C4H9)3SnOONa
-гидрофобизирующий агент для целлюлозы, хлопкового текстиля, бумаги, дерева;
[(C4H0),Sn]2O, Ph,SnOCOCH3 и [(C4H9)3SnO]3PO-фунгициды,
(цикло-С6Н11)SnOH (цигек-сатин)-акарицид, (C4H9)3SnX
и Ph3SnX (X = F, ОСОСН3 и др.)-биоцидные компоненты противообрастающих
красок.
Тетраалкилолово, а также
гидриды, алкоксиды, амиды Sn и др. применяют в орг. синтезе.
О. с., особенно производные
триалкилолова R3SnX, высокотоксичны, токсичность О. с. R2SnX,
значительно ниже.
Мировой объем ироиз-ва
О.с. 35 тыс. т (1980).
Лит.: Методы элементоорганической
химии. Германий, олово, свинец, под общ. ред. А. Н. Несмеянова и К. А. Кочешкова,
М., 1968; Comprehensive organometallic chemistry, ed by G.Wilkinson, v. 2, N.Y.-[a.o.],
1982, p. 519-628.
A.C. Перегудов.


