ОППЕНАУЭРА РЕАКЦИЯ
(окисление по Оппенауэру), окисление (дегидрирование) первичных и вторичных
спиртов до карбонильных соед. действием др. карбонильного соед. в присут. алкоголята
металла:
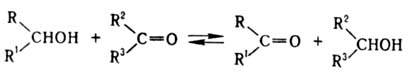
Р-цию осуществляют в мягких
условиях. Катализаторы -изопропилаты, трет-бутилаты, феноляты Аl, К, Na или
Zr(II), смешанные алкоголяты редкоземельных металлов (изо-С3Н7ОСеI2,
трет-C4H9OSmI2), Mg, Al; промоторы -вторичные
алифатич. амины.
О. р. является обратной
по отношению к Меервейна-Понн-дорфа-Верлея реакции (восстановление карбонильных
соед.). Положение равновесия определяется различием в окислит.-восстановит.
потенциалах реагирующих соединений. Равновесие сдвигают вправо применением избытка
исходного карбонильного соед. и(или) выведением образующегося соед. из сферы
р-ции, а также использованием карбонильных соед. с высоким окислит.-восстановит.
потенциалом. Первый способ применяют гл. обр. при окислении вторичных спиртов
(преим. окисляется экваториальная гид-роксигруппа), напр. холестерина:
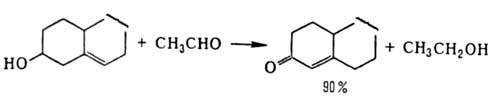
При окислении первичных
спиртов их целиком переводят в алкоголяты и дегидрируют действием альдегида,
кипящего при т-ре на 50 °С выше продукта р-ции, отгоняя последний из реакц.
массы, напр.:
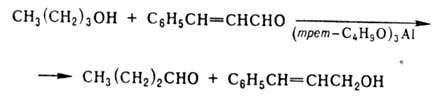
Используя соед. с высоким
окислит.-восстановит. потенциалом (напр., бензохинон), можно проводить окисление
при невозможности использования др. вариантов О. р. (напр., при получении хининона
из хинина). Выходы карбонильного соед. до 90%.
О. р. позволяет окислять
спирты, содержащие кратные связи, галогены, ацетальные, сложноэфирные и др.
лабильные группы. Побочные р-ции - миграция аллильной двойной связи в  ,
,
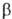 -положение
к карбонилу (напр., при окислении холестерина, см. выше) и альдольная конденсация
образующегося альдегида с кетоном - акцептором водорода (последнюю р-цию иногда
используют в синтетич. целях).
-положение
к карбонилу (напр., при окислении холестерина, см. выше) и альдольная конденсация
образующегося альдегида с кетоном - акцептором водорода (последнюю р-цию иногда
используют в синтетич. целях).
Механизм р-ции включает
превращ. окисляемого спирта в алкоголят, координацию алкоголята с карбонильным
соед. и переход гидрид-иона (эта стадия определяет скорость р-ции) в образовавшемся
промежут. комплексе:
Модификация О.р.-проведение
р-ции без алкоголятов в присут. активированного Аl2О3,
гидридов щелочных металлов, скелетного Ni или комплексных соед. переходных металлов
(эти р-ции осуществляют в гетерог. условиях), а также использование в р-ции
карбонильных соед. с высоким окислит, потенциалом (напр., тетрахлорбензохи-ноны,
2,3-дихлор-5,6-дицианобензохинон) без катализаторов.
О. р. применяют в лаб.
и пром. синтезе, особенно в химии стероидов, витаминов, алкалоидов. А. Верлей
и В. Понн-дорф в 1925-26 показали обратимость открытой ими р-ции восстановления
карбонильных соед., Р. Оппенауэр в 1937 широко это использовал в химии стероидов.
Лит.: Джерасси К.,
в кн.: Органические реакции, пер. с англ., сб. 6, М., 1953, с. 235-300; Общая
органическая химия, пер. с англ., т. 2, М., 1982, с. 103-05; Houben-Weyl, Methoden
der organischen Chemie, 4 Aufl., Bd 4, Tl Ib, Stuttg., 1975, S. 904-33. Д
В. Иоффе.


