ПЕРФТОРАЛКИЛИОДИДЫ RFI
(RF перфторалкил), бесцв. (краснеющие на свету), легколетучие жидкости
или воскообразные твердые в-ва; трифториодметан CF3I и пен-тафториодэтан
C2F5I-газы. Раств. в орг. р-рителях, не раств. в воде.
Физ св-ва нек-рых П.: CF3I,
т. кип. -22,50C, т. пл. -130,50C, 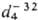 2,361
2,361 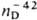 1,379,
1,379,
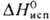 93,8 кДж/моль;
C2F5I, т кип. 12,50C, d04
2,1605,
93,8 кДж/моль;
C2F5I, т кип. 12,50C, d04
2,1605, 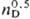 1,3378.
1,3378.
Связь С I в П. легко подвергается
гомолитич. расщеплению с образованием радикала R•F; взаимодействие
П. с олефинами при нагр.. УФ облучении или в присут. радикальных инициаторов
приводит к продуктам присоединения и теломерам, напр.
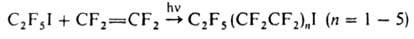
В отличие от алкилиодидов,
П. не вступают в р-ции нуклеоф замещения SN 1 и SN2,
а реагируют с нуклеофилами по ион-радикальному (SRN1)или
т наз. галогенофильному (SNX) механизму, напр
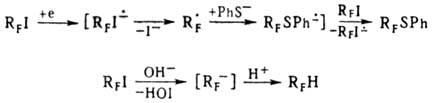
При действии металлов П.
образуют металлоорг. соединения (напр., RFZnI), вступают в р-цию
Вюрца либо восстанавливаются до моногидроперфторалканов. Окисляются фтором,
ClF3, надкислотами до соед. I(III) и I(V), омыляются олеумом в перфторкарбоновые
к-ты, напр.: RFCF2I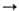
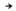 RFCOOH.
RFCOOH.
Получают П декарбоксилированием
солей перфторкар-боновых к-т в присут I, (Бородина Хунсдиккера реакция},
вторичные и третичные П. также взаимод. перфторолефи-нов с KF или AgF и
I2 В пром-сти C2F5I и (CF3)2CFI
получают взаимод. тетрафторэтилена или гексафторпропиле-на со смесью I2
и IF5, высшие П. теломеризацией тетрафторэтилена низшими П.
Высшие П. (напр., С8F17I)-полупродукты
в синтезе ПАВ, текстильных аппретур, низшие П. (CF3I, C3F7I)-активные
среды газовых лазеров. В лаб. практике П. применяют для введения в молекулы
остатка RF.
Первичные и вторичные П.-мало
либо умеренно токсичны, третичные П.-высокотоксичны; напр., для C3F7C(CF3)2Cl
ЛД50<0,03 мг/л (крысы, экспозиция 1 ч).
Лит Tarrant P..
"J. Fluor. Chem.", 1984, v. 25, № 1, p. 69 74.
А. Ю Волконский.


