ПИНАКОНЫ, вицинальные
двухатомные спирты общей ф-лы RR'C(OH)C(OH)RR', где R и R'-орг. остатки. Кристаллич.
в-ва (см. табл.); плохо раств. в холодной воде, хорошо- в этаноле, хлороформе.
СВОЙСТВА НЕКОТОРЫХ ПИНАКОНОВ
|
Соединение |
T. пл., 0C |
T. кип., °С/мм
рт.ст. |
||
|
2,3-Диметил-2,3-бутандиол
(пинакон)* (CH з)2С (ОН) С (OH)(CH3)2 |
43 |
174,35/760 75/13 |
||
|
3,4- Диэтил- 3
,4-гександиол ** (С2Н5)2С(ОН)С(ОН)(С2Н5)2 |
28 |
230/760 112/10 |
||
|
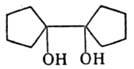
1,1 '-Бициклопентан-
1,1 '-диол |
108 |
- |
||
|
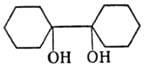
1,1'-Бициклогексан-1,1'-диол |
129-130 |
- |
||
|
2,3-Дифенил-2,3-бутандиол
C6H5(CH3)C(OH)C(OH)(CH3)C6H5 |
121-122 (a-форма) (b-форма) |
- |
||
|
Тетрафенил-1,2-этандиол
(бензпинакон) (C6H5)2 С (ОН) С (ОН)
(C6H5)2 |
193-195 |
- |
||
* 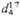 0,9641,
0,9641, 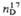 1,4430; моногидрат, т. пл. 41,25 0C; гексагидрат, т. пл. 47 0C,
1,4430; моногидрат, т. пл. 41,25 0C; гексагидрат, т. пл. 47 0C,
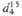 0,967.
**
0,967.
** 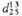 0,9630,
0,9630,
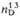 1,467.
1,467.
П. легко образуют ассоциаты
с водой (гидраты), гало-геноводородными к-тами и др. соединениями. Гидраты П.
легко теряют воду при перегонке с бензолом, а также при выдержке в вакууме над
KOH или при нагревании. П. вступают во мн. р-ции, характерные для простейших
третичных спиртов (алкилирование, дегидратация, восстановление иодистоводородной
к-той и т. д.). Нек-рые П. при нагр. до
т-ры плавления распадаются по центральной связи С—С, напр.:
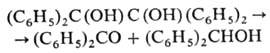
При действии минер. к-т
П. превращ. в кетоны (пинаколи-новая перегруппировка):
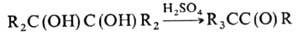
При обработке диалкилфосфитами
и др. геминальными дифункциональными реагентами П. гетероциклизуются; при этом
для П. эти процессы проходят значительно результативнее, чем соответствующие
превращ. обычных гликолей из-за взаимод. боковых алкильных групп (эффект Инголда-Торпа).
Получают П. чаще всего
электрохим. восстановлением кетонов по схеме:
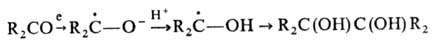
Для восстановления используют
также амальгаму Mg или Al, Zn (иногда в присут. TiCl4), нек-рые реактивы
Гриньяра, напр. (C6H5)3CMgBr. Др. способ синтеза
П.-взаимод. магнийорг. соед. с a-дикетонами или эфирами щавелевой к-ты:
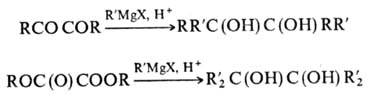
Ограниченное применение
имеют методы синтеза П. окислением тетраалкилэтиленов и гидролизом тетраалкилди-галогенэтанов:
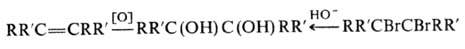
В пром-сти применяют 2,3-диметил-2,3-бутандиол
для получения пинаколина (2,2-диметил-З-бутанон); ранее этот П. применялся в
синтезе 2,3-диметилбутадиена (дегидратацией над Al2O3),
дающего при полимеризации каучуко-образный продукт.
Лит.: Органикум,
пер. с нем., т. 2, M., 1979, с. 120, 267.
Э. E. Нифантъев.