ПЛАТИНОВЫЕ МЕТАЛЛЫ
(платиноиды), семейство из 6 хим. элементов VIII гр. периодич. системы, включающее
рутений (ат.
н. 44), родий (45), палладий (46), осмий (76), иридий
(77), платину (78). Вместе с Au и Ag составляют группу благородных
металлов. Подразделяются на легкие (Ru-Pd) и тяжелые (Os-Pt).
Распространенность в природе
и природные источники. Содержание П.м. в земной коре (% по массе): Pt 5·10-7,
Pd 1·10-6, Ir 1·10-7, Rh 1·10-7, Os 5·10-6,
Ru 5·10-7 (по Виноградову). Руды П. м. бывают коренные и россыпные,
а по составу - собственно платиновые и комплексные (мн. коренные месторождения
медных и медно-никелевых сульфидных руд, россыпные месторождения Au с Pt, а
также Au с осмистым Ir). Известно более 100 минералов П.м., они бывают двух
типов. В россыпях встречаются самородные Pd и Pt и разл. сплавы, в т.ч. с другими
П.м., Fe, реже-с Au (содержат также и др. металлы), капр. палладиевая платина,
железистая платина (Pt, Fe), изоферроплатина Pt3Fe, плати-нистый
палладий, осмистый иридий, иридиевая платина Pt4Ir2Fe,
платинистый иридий Ir4Pt, осмистый иридий Ir2Os, ауроосмид
(Ir, Os, Au) и др. Минералы второго типа-разл. соединения П.м. с S, Fe, As,
Bi, Pb, напр, спериллит PtAs2, куперит PtS, брэгтит (Pt, Pd, Ni)S,
стибиопалладинит Pd3Sb, лаурит RuS2, холлингуореит (Rh,
Pt, Pd, Ir)(AsS)2 и др. Минералы этого типа встречаются в виде твердых
р-ров в медно-никелевых сульфидных рудах, являющихся осн. пром. источником П.м.
На долю вторичных источников П.м. (лом, отработанные катализаторы и др.) приходится
от 10 до 33% ежегодного мирового произ-ва этих металлов. Нек-рые изотопы Pd,
Ru и Rh накапливаются в продуктах деления U и Pu в ядерных реакторах.
ХАРАКТЕРИСТИКА ПЛАТИНОВЫХ
МЕТАЛЛОВ
|
Показатель |
Ru |
Rh |
Pd |
Os |
Ir |
Pt |
||
|
Конфигурация внеш.
электронных оболочек атома |
|
|
|
|
|
|
||
|
М0 |
4d75s1 |
4d85s1 |
4d10 |
5d66s2 |
5d76s2 |
5d96s1 |
||
|
Атомный и ионный
радиусы*, нм |
|
|
|
|
|
|
||
|
М0 |
0,134 |
0,1342 |
0,137 |
0,135 |
0,135 |
0,138 |
||
|
M4 + |
0,076 |
0,074 |
0,076 |
0,077 |
0,077 |
0,077 |
||
|
T. пл., 0C |
2334 |
1963 |
1554 |
3027 |
2447 |
1769 |
||
|
T. кип., 0C |
4077 |
3727 |
2937 |
5027 |
~4380 |
-3800 |
||
|
Плотн., г/см3 |
12,45 |
12,41 |
12,02 |
22,61 |
22,65 |
21,45 |
||
|
С0p,
Дж/(моль·К) |
24,0 |
24,95 |
25,8 |
24,7 |
25,1 |
25,85 |
||
|
S0298,
Дж/(моль·К) |
28,56 |
31,48 |
37,65 |
32,6 |
35,54 |
41,6 |
||
|
|
38,3 |
21,53 |
16,7 |
31,8 |
26 |
20 |
||
|
|
647,4 |
495,3 |
353 |
747,4 |
667,8 |
510 |
||
* Ионные радиусы даны по
Шеннону при координац. числе 6.
** DHпл
и DHисп приведены при т-рах соотв. плавления и кипения.
Мировые прогнозные ресурсы
П.м. (без социалистич. стран) оцениваются в 75050 т (1985), в т.ч. в ЮАР 62000,
США 9300, Зимбабве 3100, Канаде 500, Колумбии 150 т. В осн. это запасы Pt (65%)
и Pd (30-32%).
Свойства. П. м.-светло-серые
или серебристые тугоплавкие, труднолетучие металлы (см. табл.); Rh, Pd, Ir,
Pt кристаллизуются в гранецентрир. кубич. решетке, Os и Ru- в гексагональной
плотноупакованной. По мех. св-вам П.м. заметно различаются: Pt-мягкая, пластичная,
легко вытягивается в тончайшую проволоку и прокатывается в фольгу, почти так
же пластичен Pd; Os и Ru-хрупкие, Ir-твердый и прочный.
Наиб. характерные степени
окисления для палладия +2, платины +2 и +4, иридия +2 и +3, осмия +4, +6 и +8,
родия +3, рутения +3, +4 и +8. П.м. обладают исключительно высокой каталитич.
активностью, чаще других как катализаторы используют Pt и Pd. Палладий и в меньшей
степени Pt хорошо растворяют H2, Pd растворяет H2 лучше
всех металлов (до 800 объемов).
П.м. отличаются хим. инертностью,
наиб. химически стойка Pt. Палладий раств. в горячих конц. HNO3 и
H2SO4, Pt и Pd и в меньшей степени RU- в царской водке,
Ru в присут. окислителей взаимод. с H2SO4 и HClO4,
Rh медленно реагирует с конц. H2SO4, HBr, Pt медленно
взаимод. с кипящей H2SO4 и горячей HNO3, медленно
раств. в конц. HBr
и HI. Все П. м. раств. в царской водке после оглавления с KHSO4 или
спекания с неорг. пероксидами. П. м. взаимод. при нагр. со щелочами в присут.
O2. С O2 воздуха П.м. образуют тончайшие оксидные пленки
на пов-сти: Os при 500-6000C, Ru выше 4500C, Pt при 900-10000C,
Ir и Rh ок. 2000 0C. Os может гореть на воздухе, a HNO3
окисляется до OsO4.
Известны сотни простых
и тысячи комплексных соединений П.м. В р-рах существуют только комплексные ионы
П.м. Устойчивость высоких степеней окисления П.м. в комплексных соед. уменьшается
в рядах Ru > Rh > Pd и Os > Ir > Pt. П. м., особенно в низких степенях
окисления, представляют собой мягкие льюисовские к-ты по Пирсону; в водных р-рах
устойчивость галргенидных комплексов уменьшается в ряду F - <Cl
- < Вг - <I -, а в случае многоатомных
лигандов, в т.ч. органических,-в ряду донорных атомов О < N < S С.
Одна из особенностей химии П. м.-кинетич. инертность комплексов этих металлов
в р-циях замещения лигандов в координац. сфере. Инертность комплексов в существ.
степени зависит от степени окисления П. м. и природы лиганда, но в целом уменьшается
в ряду Ir > Rh > Pt > Ru > Os > Pd.
С.
Одна из особенностей химии П. м.-кинетич. инертность комплексов этих металлов
в р-циях замещения лигандов в координац. сфере. Инертность комплексов в существ.
степени зависит от степени окисления П. м. и природы лиганда, но в целом уменьшается
в ряду Ir > Rh > Pt > Ru > Os > Pd.
Получение. Способ
извлечения и разделения П. м. существенно зависит от типа исходного сырья. Переработка
россыпей сводится к добыче песка и его обогащению гравитац. методами. Переработка
медно-никелевых сульфидных руд обычно включает операции мех. и флотац. обогащения,
пирометаллургич. переработки концентратов и гидрометаллургич. рафинирования
(аффинаж).
При переработке медно-никелевых
сульфидных руд П.м. концентрируются в разл. полупродуктах произ-ва; большая
часть, особенно Pd и Pt, концентрируется в анодных шламах (после электролитич.
рафинирования Cu и Ni); из них получают концентраты П.м., к-рые направляют на
аффинажные заводы. Схемы аффинажа П.м. включают после-доват. операции обработки
концентрата хим. реагентами. Напр., для выделения Pd и Pt концентраты П. м.
обрабатывают царской водкой. К фильтрату, содержащему Pt, Pd и Au, добавляют
FeSO4 и осаждают Au. Из р-ра, содержащего Pd и Pt в виде [PtCl6]2-
и [PdCl4]2-, добавлением NH4Cl осаждают (NH4)2[PtCl6],
к-рый прокаливают до платиновой губки, затем повторяют растворение в царской
водке, осаждение и прокаливание. Р-р, содержащий Pd, обрабатывают водным NH3
и соляной к-той, при этом осаждается Pd(NH3)2Cl2;
переосаждение повторяют до получения чистого в-ва, к-рое прокаливают до палладиевой
губки. Из оставшегося после обработки царской водкой концентрата, используя
последоват. операции сплавления, растворения и осаждения, получают чистые (NH4)3[RhCl6],
(NH4)3[RuCl6], (NH4)2[IrCl6],
к-рые прокаливают в атмосфере H2 до Rh, Ru, Ir. В ряде схем аффинажа
используют экстракц. методы. Высокочистые П. м. получают методом зонной плавки,
вытягиванием монокристаллов из расплава.
Определение. При
анализе проб, содержащих от 10-8-10-7 до ~10% П. м., часто
необходимо предварит. кон-центрирование и разделение П.м. Чаще всего для этого
используются метод пробирной плавки (см. Пробирный анализ), сорбц. и
экстракц. концентрирование. Метод пробирной плавки основан на высокотемпературном
извлечении П. м. расплавленными Pb, Ag, Cu, сплавами Pb с Ag, Cu с Ni, NiS.
При сорбц. методах концентрирования
наиб. применение находят сорбенты с комплексообразующими группами. Для разделения
П.м. в виде заряженных комплексов с неорг. и орг. лигандами используют хроматографич.
методы. Экстракц. методы основаны на избират. извлечении орг. р-рит о-лями из
водных р-ров соединений П.м. с экстрагентами. Для концентрирования Ru и Os используют
избират. отгонку и экстракцию оксидов MO4.
Для анализа проб с низким
содержанием П.м. (горные породы, руды и продукты их переработки, технол. р-ры,
морская вода и рассолы, речная вода, сбросные воды, реактивы) используют нейтронно-активац.,
атомно-эмиссионный,
атомно-абсорбц., ренттенофлуоресцентный, спект-рофотометрич. методы анализа.
Для сплавов, концентратов П. м., отработанных катализаторов, вторичного сырья
П. м. применяют рентгенофлуоресцентный, кулонометрич., атомно-абсорбц., гравиметрич.
методы. Примеси благородных и неблагородных металлов в П. м. определяют масс-спектро-метрич.,
атомно-эмиссионным и атомно-абсорбционными методами.
Применение. П.м.
применяют в виде индивидуальных металлов и их сплавов друг с другом, а также
с Au, Ag, Со, Cu и др. Сплавы П.м. обладают большей твердостью, прочностью и
устойчивостью к коррозии по сравнению с индивидуальными металлами. Осн. области
применения П. м. и их сплавов: катализаторы гидрирования, дегидрирования, окисления,
дожигания выхлопных газов автомобилей, в топливных элементах; легирующие добавки
в сплавах; материалы для высокотемпературных термопар, термометров сопротивления,
электрич. печей сопротивления, химически стойкой посуды, электродов, электрич.
контактов, мед. инструментов, стеклоплавильных аппаратов; осн. компонентов резистивных
и конденсаторных материалов; тугоплавкие припои; компоненты постоянных магнитов
(напр., сплав Pt-Co); защитные покрытия на металлах; ювелирная пром-сть.
История открытия П.м. началась
в сер. 18 в., когда испанцы в Южной Америке обнаружили, что при промывке песка
вместе с золотом отмывались тяжелые серебристые песчинки, к-рых иногда было
больше золота. Такой "песок" загрязнял золото, т. к. по внеш. виду
он напоминал серебро и в то же время был полностью "бесполезен",
его уничижительно назвали серебришком (plata - по-испански серебро). Однако
послед. исследование образцов "тяжелого песка" позволило выделить
пять новых элементов. На рубеже 18 и 19 вв. в Великобритании (У. Волластон,
С. Теннант), России (А. А. Мусин-Пушкин) и Франции (Л. Воклен, А. Фуркруа) разработаны
методы получения ковкой платины, в 1803 Волластон получил Pd, в 1804 он же выделил
Rh, а Теннант -Ir и Os. Значительно позднее, в 1844, после четырех лет исследований
уральской руды профессор Казанского университета К. К. Клаус выделил новый металл,
к-рый он назвал рутением в честь России (ср.-век. лат. Ruthenia-Россия).
Лит.: Аналитическая
химия платиновых металлов, M., 1972; Ливинг-стон С., Химия рутения, родия, палладия,
осмия, иридия, платины, пер. с англ., M., 1978; Пробоотбирание и анализ благородных
металлов. Справочник, 2 изд., M., 1978; Платина, ее сплавы и композиционные
материалы, M., 1980; Юделевич И. Г., Старцевa E. А., Атомно-абсорбционное определение
благородных металлов, Новосиб., 1981; Благородные металлы. Справочник, M., 1984;
Металлургия благородных металлов, 2 изд., M., 1987; Griffith W. R., The chemistry
of the rares platinum metals (Os, Ru, Ir and Rh), ed. by A. Cotton, G. Wilkinson,
L., 1967. O. M. Петрухин.



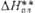 , кДж/моль
, кДж/моль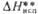 , кДж/моль
, кДж/моль