ПРОТАКТИНИЙ (от греч.
protos -первый и актиний; лат. Protactinium) Pa, радиоактивный хим. элемент
III гр. периодич. системы, ат. н. 91, ат. м. 231,0359; относится к актиноидам.
Стабильных изотопов не имеет. Известно 20 изотопов с мае. ч. 216-218, 222-238.
Наиб. долгоживущий изотоп-231Ра (Т1/2 3,28·104
лет. поперечное сечение захвата тепловых нейтронов 2·10-26 м2),
входит в радиоактивный ряд 235U. Конфигурация внеш. электронных оболочек
атома 5s25p65d105f26s26p66d17s2,
степени окисления +4 и +5 (наиб, устойчивая), редко +3; электроотрицательность
по Полингу 1,14; атомный радиус 0,163 нм, ионные радиусы для Ра4+
0,0944 нм, Ра5+ 0,090 нм.
Содержание П. в земной
коре 1·10-10 % по массе, в урановых рудах-3·10-7 частей
на 1 часть U.
Свойства. П.-светло-серый
металл. Существует в двух модификациях: ниже 1170°С устойчива a-форма
с тетрагон. решеткой, а = 0,3925 нм, с = 0,3238 нм; выше 1170°С-форма
с кубич. гранецентрированной решеткой, а = 0,381 нм, DH полиморфного
перехода 6,7 кДж/моль. Т. пл. 1572°С, т. кип. 4487°С; плотн. 15,37 г/см3;
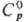 27,7 ДжДмоль·К);
27,7 ДжДмоль·К);
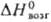 552 кДж/моль;
552 кДж/моль;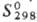 51,9
ДжДмоль·К).
51,9
ДжДмоль·К).
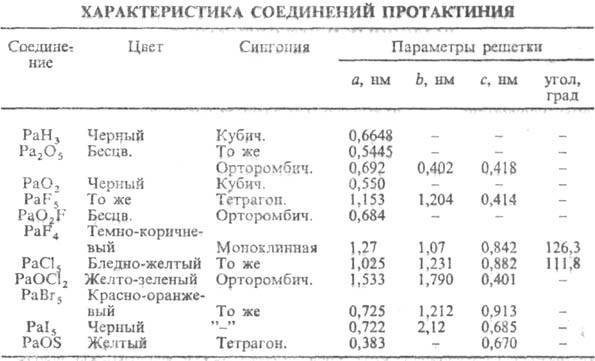
Характеристики нек-рых
соединений П. приведены в таблице. Кубич. модификацию оксида Pa(V) получают
нагреванием при 500 °С гидроксида П., осажденного водным NH3
из р-ров солей Pa(V). При нагр. в присут. BrF5 при 500 :С кубич.
модификация Ра2О5 переходит в орторомби-ческую. Диоксид
РаО2 получают восстановлением РаС15 до РаС14
(цинком с послед, гидролизом РаС14). Пента-хлорид РаС15
(т. пл. 306°С, т. кип. 420°С,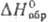 —1154 кДж/моль), пентабромид РаВr5 (т. пл. 283°С, т. кип. 428°С,
—1154 кДж/моль), пентабромид РаВr5 (т. пл. 283°С, т. кип. 428°С,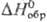 —878
кДж/моль) и пентаиодид PaL синтезируют
взаимод. Ра2О5 соотв. с фосгеном при 550 °С либо смесью
С12 с СС14 при 300-400°С, с А1Вr3 или АlI3,
а пентафторид РаF5-р-цкей PaF4 с F2 при 100°С.
Нагреванием в токе О2'РаНа15 (Hal = Cl, Br, F) при 300
°С получен РаОС13, при 350°С-РаОВr3, а при 160°С-Pa2OF8,
к-рый также м. б. синтезирован при действии F2 или смеси HF и О2
на Ра2О5.
—878
кДж/моль) и пентаиодид PaL синтезируют
взаимод. Ра2О5 соотв. с фосгеном при 550 °С либо смесью
С12 с СС14 при 300-400°С, с А1Вr3 или АlI3,
а пентафторид РаF5-р-цкей PaF4 с F2 при 100°С.
Нагреванием в токе О2'РаНа15 (Hal = Cl, Br, F) при 300
°С получен РаОС13, при 350°С-РаОВr3, а при 160°С-Pa2OF8,
к-рый также м. б. синтезирован при действии F2 или смеси HF и О2
на Ра2О5.
Оксисульфид РаОS получают
действием смеси H2S и CS2 на РаС15 при 900
°С в присут. О2, н и т р и д PaN2 - восстановлением
PaF4 металлич. Ва в графитовом тигле при 1400 °С в атмосфере
N2 .
В водных р-рах стандартный
электродный потенциал для пары Pa(V)/Pa(IV) 0,1 В, Pa(IV)/Pa(III) -1,8В, Ра(III)/Ра°
-1,6 В,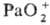 /Pa(IV)
0,1 В,
/Pa(IV)
0,1 В,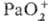 /Ра°
-1,35 В. При действии
в водных р-рах на ион Ра5+ сильных восстановителей (амальгама Zn,
Cr2+, Ti3+ и V2+) образуется неустойчивый ион
Ра4+.
/Ра°
-1,35 В. При действии
в водных р-рах на ион Ра5+ сильных восстановителей (амальгама Zn,
Cr2+, Ti3+ и V2+) образуется неустойчивый ион
Ра4+.
Получение. Изотоп 231Ра
выделяют из уранового сырья с применением осадительных, экстракционных и ионообменных
методов. Всего к 1988 выделено ок. 150 г П. Он м. б. также получен при переработке
ядерного топлива реакторов с торий-урановым циклом. 233Ра(T1/2
27,4 сут) образуется при облучении Th нейтронами в ядерных реакторах. Металлический
П. получают восстановлением PaF4 парами Ва или Са при 1500°С.
Применение. 231
Ра -исходный нуклид для получения 232U, к-рый используют для изготовления
атомных батарей. 233Ра (у-излучатель) применяют в научных исследованиях.
П. высокотоксичен. ПДК
231Ра в открытых водоемах и воздухе рабочих помещений соотв. 12,2
и 5,6·10-7 Бк/л.
П. открыли в 1918 О. Ган
и Л. Майтнер в- Германии и независимо от них-Ф. Содди и Дж. Кранстон в Великобритании.
Лит. Пальшин Е.
С., Мясоедов Б. Ф., Давыдов А. В., Аналитическая химия протактиния, М., 1968;
Keller С, "Chem. Ztg", 1978, Bd 102, №9, S. 301 23. Б. Ф. Мясоедов


