РАЙССЕРТА РЕАКЦИЯ,
получение альдегидов взаимод. хлорангидридов карбоновых к-т с хинолином и синильной
к-той (или KCN) и последующим кислотным гидролизом образующихся 1-ацил-2-циано-1,2-дигидрохинолинов
(соед. Райссерта, ф-ла I), напр.:
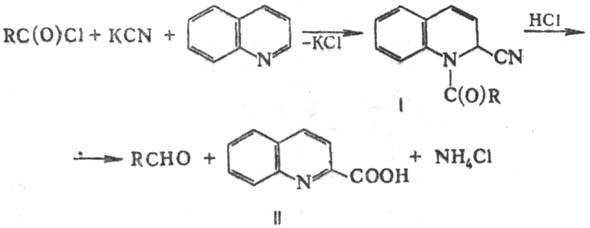
Р-цию осуществляют в водной
или в безводной среде (напр., в бензоле или жидком SO2). Возможно
также ее проведение в условиях межфазного катализа, напр. в присут. бензил-триметиламмонийхлорида
в системе СН2С12-Н2О. Выход сосд. Райссерта
составляет 35-95%. Гидролиз последних в кислой среде (обычно используют H2SO4,
Н3РО4, НС1 или НВr) почти с количеств. выходом приводит
к соответствующим альдегидам и хинальдиновой к-те (II). Вместо хинолина в р-ции
можно использовать его замещенные (положения 2 и 8 должны быть не заняты), а
также изохино-лин и фенантридин.
Предполагают, что механизм
гидролиза соед. Райссерта включает образование промежут. аммониевых соед.:
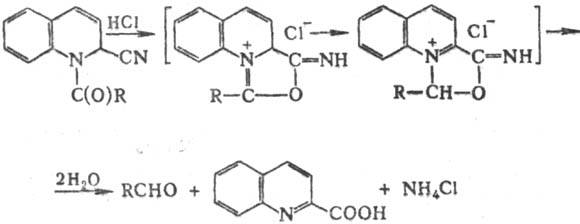
Введение электроноакцепторных
заместителей в молекулу хлорангидрида карбоновой к-ты или хинолина (изохиноли-на)
снижает выходы соед. Райссерта. P.p., являясь общим методом получения алифатич.,
циклоалифатич. и ароматич. альдегидов, находит также применение в синтезе соединений
Райссерта, к-рые широко используют для синтеза гетеро-циклич. карбоновых к-т
и их нитрилов, гетероциклич. спиртов, а также алкилированных хинолинов и изохин-олинов.
Р-ция открыта А. Райссертом в 1905.
Лит.: Мозеттиг Э.,
в сб.: Органические реакция, пер. с англ., сб. 8, М., 1956, с. 288-332; Общая
органическая химия, пер. с англ., т. 3, М., 1982, с. 653-66; Chenevert R. [е.
о.], "Synth. Communs", 1983, v. 13, № 13, p. 1095-101.
С. К. Смирнов.


