РАСТВОРЕНИЕ твердых
тел, гетерогенное физ.-хим. взаимод. твердого тела и жидкости, сопровождающееся
переходом твердой фазы в р-р; один из осн. процессов хим. технологии. Р. следует
отличать от экстрагирования, при к-ром контактирующие с р-ром твердые
частицы состоят из двух или более р-римых и инертных твердых фаз, а Р. носит
избират. характер (см. также Выщелачивание).
Различают физическое, химическое
и электрохимическое Р. При физическом Р. переход в р-р в-ва не сопровождается
изменением его хим. состава; в-во можно выделить в твердом состоянии с помощью
выпаривания и кристаллизации. При химическом Р. переход в-ва в р-р сопровождается
хим. р-цией; исходное в-во нельзя выделить из р-ра в твердом состоянии физ.
методами (примеры-Р. металлов или их оксидов в к-тах, Р. фосфоритов либо апатитов
в сернокислотном р-ре с получением Н3РО4 и др.). Электрохимическое
Р. протекает в условиях, когда процессу сопутствует перенос электрич. зарядов.
Наиб. изучены закономерности и практика Р. твердых в-в с ионной кристаллич.
решеткой (гл. обр. соли), к-рым в осн. посвящена данная статья.
Физико-химические основы
процесса
Р. сопровождается поглощением
или выделением теплоты. Тепловой эффект Р. находят по ур-нию: DHр
= U — — DHг(с), где 17- энергия кристаллич. решетки
растворяемой соли, DHг(с) - теплота гидратации (сольватации)
перешедших в р-р ионов соли. При U > DHг(с)
и DHр > 0 процесс эндо-термичсн; при U < DHг(с)
и DHр > 0 процесс экзотермичен. Условия самопроизвольного
протекания процесса определяются знаком величины DG, к-рую вычисляют
по выражению: DG = DHр — TDS,
где Т-абс. т-ра; DS-изменение энтропии. При DG
< 0 вероятно Р., при DG > 0 вероятен обратный процесс-кристаллизация.
Расчет может дать положит. либо отрицат. результат (отсутствие или наличие растворимости).
При нек-рой концентрации,
наз. концентрацией насыщения сн, между твердым телом и жидкостью
устанавливается равновесие. При нем хим. потенциал в-ва в р-ре становится равным
хим. потенциалу того же в-ва в твердом состоянии. Концентрация сн
не зависит от давления, однако в значит. степени определяется т-рой, с увеличением
к-рой р-римость возрастает. Последняя оказывает сильное влияние на кинетику
Р. С увеличением р-римости возрастает разность концентраций (движущая сила процесса)
и Р. ускоряется (см. также Растворы).
Физическое Р. может протекать
по диффузионному, кине-тич. или смешанному механизму (см. Массообмен).
Рассмотрим наиб. распространенный диффузионный механизм. При Р. на пов-сти
растворяющегося тела возникает диффузионный пограничный слой, в пределах к-рого
концентрация изменяется от сн на пов-сти тела до концентрации
с в осн. массе р-ра. При погружении тела в неподвижную жидкость в пределах
диффузионного слоя возникает движение жидкости, побуждаемое разностью плотностей
ее и тела в слое и вне его (естеств. конвекция). При погружении тела в движущуюся
жидкость в пределах диффузионного слоя также возникает движение, скорость к-рого
снижается по мере приближения к пов-сти тела (вынужденная конвекция, ускоряемая
перемешиванием). При этом толщина слоя зависит от его диффузионных и гидродинамич.
параметров и уменьшается с увеличением числа Рейнольдса Re = ud/v
(u-скорость обтекания
жидкостью объекта P., d-eгo размер, v-кинематич. вязкость
жидкости).
Осн. закон кинетики .диффузионного
P.: —dM/dt = = kF(cн — с), где М-масса растворяющегося
в-ва, t-время, k-коэф. массоотдачи, F-площадь пов-сти Р.
Параметр k определяется ур-ниями в обобщенных переменных (табл.; см.
Подобия теория).
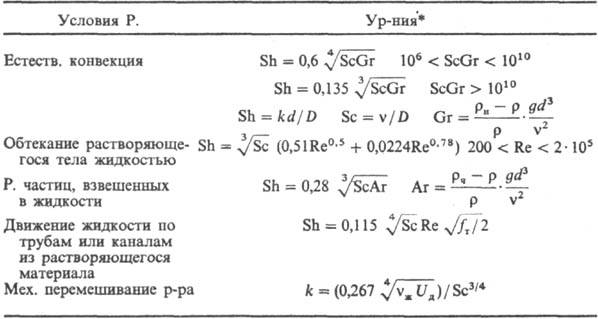
* Обозначения: D-коэф.
диффузии; g- ускорение своб. падения; r-плотн. р-ра; rн-плотн.
насыщ. р-ра; rч-плотн. твердых частиц; fт
- коэф. трения; Uд = = N/rVж-среднее
значение диссипации энергии в единице массы перемешиваемой жидкости; N = x
r w3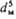 -
мощность, затрачиваемая на перемешивание; Vж- объем
жидкости в аппарате; w-частота вращения мешалки; dм-
диаметр окружности, описываемой мешалкой; 4-коэф. сопротивления вращению
мешалки.
-
мощность, затрачиваемая на перемешивание; Vж- объем
жидкости в аппарате; w-частота вращения мешалки; dм-
диаметр окружности, описываемой мешалкой; 4-коэф. сопротивления вращению
мешалки.
Химическое Р. может протекать
без образования или с образованием новой фазы.
Р. без образования новой
фазы (продукты р-ции растворены в жидкости). Скорость процесса находят из выражения:
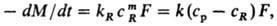
где kR-константа
скорости р-ции на пов-сти Р.; ср, сR-концентрации
реагента (к-та, щелочь) в осн. массе р-ра и на пов-сти Р.; m-стехиометрич.
коэффициент. При т = 1 имеем:
-dM/dt = Fcp/(1/kR+1/k).
Аналогично физическому
Р. в данном случае также различают диффузионный, кинетич. и смешанный механизмы.
Р. с образованием новой
твердой фазы. Возможно неск. вариантов процесса.
1) Твердый продукт р-ции
немедленно удаляется с пов-сти Р.; при этом скорость процесса остается постоянной
(при F = const и с = const).
2) Твердый продукт образует
пленку с постоянной по толщине пористостью, плотно связанную с исходным твердым
материалом. По мере протекания процесса толщина пленки возрастает, а скорость
процесса снижается. Анализ кинетики Р. сферич. частиц (наиб. распространенный
случай) в описанных условиях приводит к выражению:
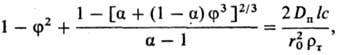
где f = r/r0;
a = m'(rт/rп); r0,
r-начальный и текущий радиусы растворяющейся сферы из исходного в-ва;
rт, rп-плотн. в-ва и продуктов р-ции; Dп-коэф.
диффузии в-ва сквозь пленку продуктов; l, m'-стехиометрич. коэф. пересчета
от исходного в-ва к реагенту и от продуктов р-ции к растворяющемуся в-ву.
3) Образующаяся твердая
фаза кристаллизуется в р-ре, что обусловлено его пересыщением, и осаждается
на пов-сти Р. Ее экранирование тем значительнее, чем выше концентрация твердых
частиц в р-ре.
Р. с образованием газообразной
фазы встречается особенно часто (Р. металлов в к-тах и разложение ими
карбонатов или сульфитов с выделением Н2, СО2 или SO2).
Газообразные продукты оказывают сильное, иногда определяющее влияние на химическое
Р.: изолируют от жидкого реагента пов-сть р-ции и способствуют хорошему перемешиванию
р-ра вблизи этой пов-сти благодаря выделению газовых пузырьков. Интенсивность
пузырькового режима, число пузырьков и частота их образования зависят от концентрации
реагента. С ее увеличением возрастает константа скорости kR. При
определенной концентрации реагента, наз. критической, константа достигает максимума,
а при дальнейшем увеличении уменьшается.
Для мн. объектов Р. в условиях
газовыделения протекает в диффузионной области; закономерности изменения конста.нты
kR объясняются следующим образом: с возрастанием концентрации
реагента интенсифицируется пузырьковый режим, что способствует турбулизации
пограничного слоя и уменьшению толщины диффузионного слоя, т.е. интенсификации
транспорта реагента к пов-сти Р. Одновременно ускоряется экранирование пов-сти
(изоляция ее от жидкой среды), вследствие чего по достижении критич. концентрации
величина kR начинает снижаться. Помимо концентрации реагента
на константу скорости влияют вязкость жидкости (с ее увеличением kR
уменьшается) и давление в системе; при возрастании последнего рост пузырьков
и общая интенсивность пузырькового режима снижаются, что также приводит к уменьшению
kR.
Опытные данные по кинетике
Р. ряда объектов обобщены критериальными ур-ниями, к-рые применимы к концентрациям,
не превышающим критические:
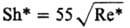 Sc < 300
Sc < 300 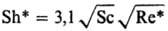 Sc>300 10-3<Re*<102
Sc>300 10-3<Re*<102
Sh* = (kR
d)/DR Sc* = (lqR d)/(rruж)
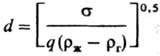 Sс=uж/DR,
Sс=uж/DR,
где s-поверхностное
натяжение жидкости; DR-коэф. диффузии реагента; rж,
rг-плотн. жидкости и газа; qR-плотн. потока
реагента к пов-сти Р.; l-стехиометрич. коэффициент. Обобщение выполнено
с учетом результатов экспериментов по P. Mg, Мn, СаСО3, СuСО3
· Сu(ОН)2 в к-тах (НС1, HNO3, H2SO4).
Известно немало случаев, когда Р. металлов и сплавов протекает в кинетич. области;
так, А1 и его сплавы раств. в р-рах щелочей, а константа скорости Р. удовлетворяет
ур-нию: kR = k0e-E/RT (Е-энергия
активации, R-газовая постоянная, Т-абс. т-ра).
Закономерности Р. техн.
металлов и их сплавов связаны с электрохим. явлениями (см. Коррозия металлов,
Электрохимическая кинетика).
Способы организации
и аппаратурное оформление
Схемы процесса. Пром. реализация
Р., проводимого в аппаратах-растворителях, связана с определенной схемой взаимод.
твердой и жидкой фаз: замкнутый периодич. процесс (напр., в аппарате с мешалкой);
прямоточное или противоточное Р., при к-ром фазы движутся соотв. в одном направлении
либо в противоположных направлениях; периодич. Р. в слое растворяющихся частиц
(жидкость фильтруется через неподвижный стационарный слой). В крупнотоннажных
произ-вах наиб. распространены прямоточная и противоточная схемы. При прямотоке
пов-сть Р. и движущая сила (сн — с) одновременно уменьшаются,
что приводит к замедлению процесса. При противотоке уменьшение пов-сти Р. сопровождается
увеличением разности концентраций, а скорость Р. более постоянна. Выбор схемы
Р. зависит также и от др. факторов, напр. от размера частиц растворяющегося
в-ва. Так, при Р. полидисперсной смеси частиц в противоточном аппарате трудно
избежать выноса за его пределы мелкой фракции вместе с жидкостью.
В практике Р. широко применяют
комбинир. схемы, комплектуемые из ряда аппаратов. Так, каждый аппарат в отдельности
работает по принципу прямотока, а вместе соединены в противоточную схему. Р.
обычно предшествует измельчение твердого материала, что способствует ускорению
процесса, но требует больших энергетич. затрат и затрудняет фильтрац. очистку
полученного р-ра. Размер частиц, поступающих на Р., находят оптимизацией его
самого и всей совокупности сопутствующих процессов.
При галургич. переработке
минер., сырья важную роль играет Р. многокомпонентных солевых систем. Напр.,
в основе получения КС1 из сильвинита лежит частичное P. NaCl и почти полное
P. KC1 в горячих щелоках с последующим выделением из р-ра готового продукта
при охлаждении. Кинетика Р. смеси из п компонентов определяется совместным
решением (обычно на ЭВМ) системы ур-ний:
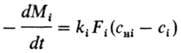
Cнi=fc(с1,
с2,..., сn)
Fi=fF(Mi)
i=1,2,...,n
и ур-ния материального
баланса типа
Mi0-Mi
= W(ci0-ci),
где Mi0-начальная
масса i-го компонента; ci0-начальная
концентрация р-ра; W-его объем.
Аппаратура. При периодич. процессе в одном и том же аппарате выполняют ряд последоват. операций: дозировку компонентов р-ра, заполнение рабочего объема, подогрев жидкости до заданной т-ры, собственно Р., отделение р-ра от нерастворимого остатка, их выгрузку, подготовку к след. циклу. К оборудованию периодич. действия, используемому в малотоннажных произ-вах и при большом ассортименте растворяемых в-в, относятся аппараты с мех. перемешиванием и со стационарным слоем растворяющихся твердых частиц. В первом случае применяют перемешивающие приспособления разл. типов, частота вращения к-рых должна быть достаточна для создания гидродинамич. силы, способной привести частицы во взвешенное состояние (см. также Перемешивание). Во втором случае р-р фильтруется сквозь слой растворяющихся и инертных частиц, а скорость фильтрования определяет кинетику Р.
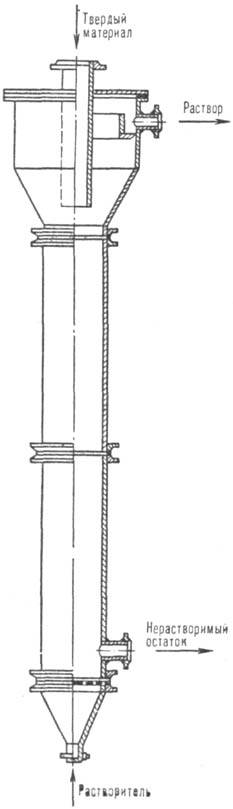
Рис. 1. Колонный аппарат
для растворе- ния в псевдоожиженном слое.
Аппараты непрерывного действия
используют для Р. больших масс материала. Каждая стадия осуществляется в отдельном
аппарате. Пром. значение имеют аппараты: с псевдоожиженным слоем растворяющихся
частиц; сочетающие Р. с гидравлич. транспортом целевых продуктов; с транспортирующими
и перемешивающимися устройствами; с движущимся слоем твердой фазы.
На рис. 1 представлен аппарат
с псевдоожиженным слоем, предназначенный для Р., напр., галитовых отходов (размер
частиц 0,5-5,0 мм) калийных предприятий. Скорость движения растворяющего рассола
должна превышать скорость псевдоожижения крупных частиц.
Трубчатый растворитель
(рис. 2) состоит из ряда последовательно соединенных вертикальных труб, через
к-рые насосом перекачивается суспензия, предварительно подготовленная в аппарате
с мешалкой 2. Скорость движения жидкости должна превышать скорость осаждения
самых крупных частиц во избежание закупорки труб. В случае аварийной остановки
насоса жидкость, содержащая и твердую фазу, спускается в горизонтальный корытный
аппарат с мешалкой 7.
К числу аппаратов с транспортирующими
и перемешивающими устройствами относится шнековый растворитель (рис. 3). Сварной
корпус корытообразной формы снабжен шнеком для перемешивания твердого материала
и наклонным ковшовым элеватором для выгрузки нерастворившегося остатка. Уменьшение
продольного перемешивания достигается секционированием аппарата спец. перегородками.
Растворяющий реагент движется к элеватору (прямоток) или в противоположном направлении
(противоток). В перспективе предполагается использование вертикальных противоточных
колонных аппаратов с движущимся слоем р-римого в-ва.
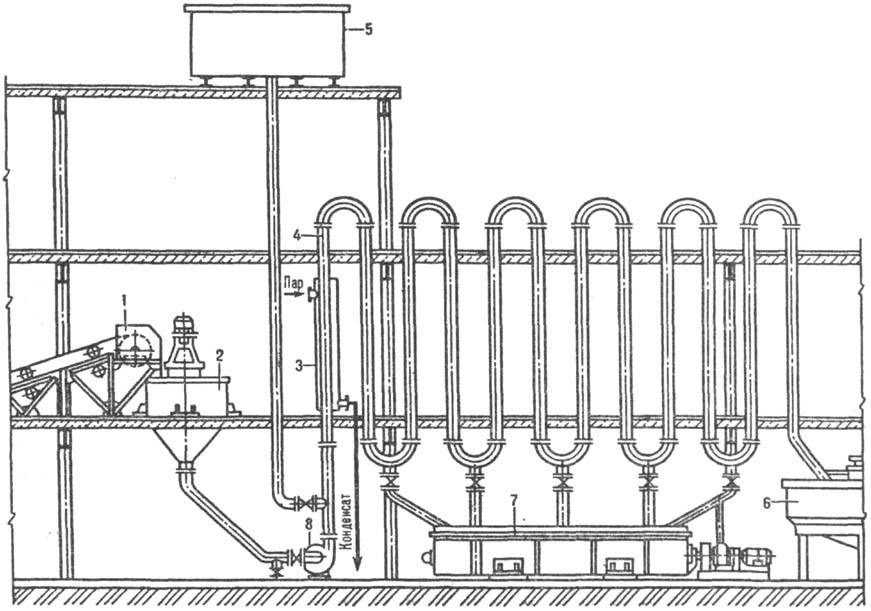
Рис. 2. Трубчатый растворитель:
1 -ленточный транспортер для твердого материала; 2, 7-аппараты с мешалками;
3-паровая рубашка; 4-вертикальные трубы; 5-бак с водой для промывки труб; 6-сгуститель;
8-насос.
Интенсификация процесса.
Скорость Р., как правило, возрастает с увеличением т-ры, однако р-р можно нагревать
до определенного предела, обусловленного пределом кипения жидкости и стоимостью
тепловой энергии. В практике Р. используют методы, основанные на обтекании твердых
частиц жидкостью, а также на систематич. обновлении пов-сти Р.: интенсивное
перемешивание мех. мешалками и др. устройствами; наложение поля колебаний (от
низкочастотных до ультразвуковых); сочетание Р. и измельчения в одном аппарате;
применение электрич. разрядов в жидкости. Два последних метода обеспечивают
высокую степень интенсификации Р. и, кроме того, эффективны, если твердые частицы
первоначально покрыты экранирующими инертными пленками или примесями.
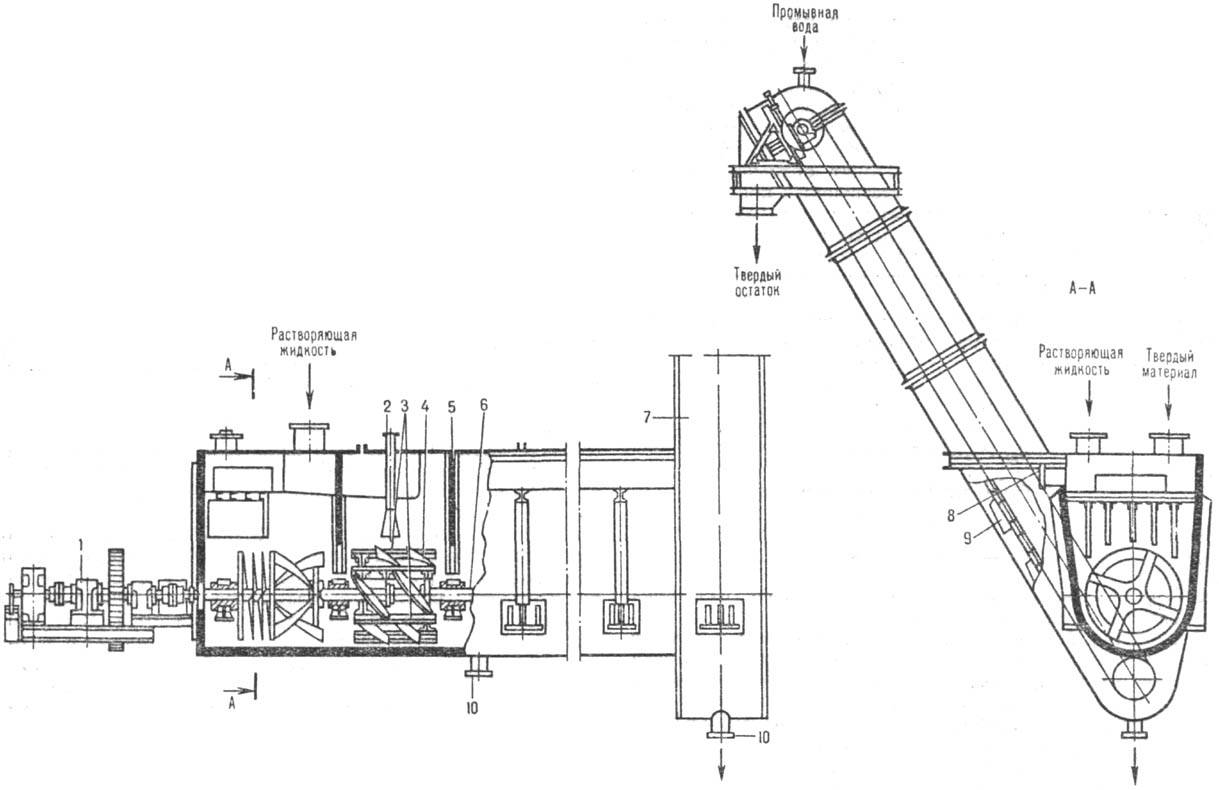
Рис. 3. Шнековый растворитель:
1 -привод; 2-сопло для пара; 3-скребки для перемешивания материала в пределах
каждой секции; 4, 6-лопасть и вал мешалки (шнека); 5 - перегородка; 7-элеватор;
8-штуцер для отвода р-ра; 9-ковш; 10-штуцеры для аварийного опорожнения.
Р. широко используют в
хим. и смежных отраслях промети для получения р-ров с последующей их переработкой
(см. Галургия), отделения р-римых в-в от сопутствующих инертных примесей
(напр., в произ-вах минер. солей и удобрений), обработки р-римых материалов,
в т.ч. металлов, с целью придания им определенных размера и формы (т. наз. химическое
фрезерование), создания полостей большого объема в соляных толщах с целью хранения
в них газов и жидкостей.
Лит.: Здановский
А.Б., Кинетика растворения природных солей в условиях вынужденной конвекции,
Л., 1956; Аксельруд Г. А., Мол чанов А. Д., Растворение твердых веществ, М.,
1977; Галургия, под ред. И. Д. Соколова, Л., 1983; Аксельруд Г. А., Гумницкий
Я. М., Дубинин А. И., "Теоретич. основы хим. технологии", 1989,
т. 23, № 1, с. 28-33; К а раж ан о в Н. А., Основы кинетики растворения солей,
А.-А., 1989. Г. А. Аксельруд.


