РЕНИЯ ОКСИДЫ. Оксид
рения(VII) Rе2О7-светло-желтые
сильно гигроскопичные кристаллы;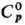 166,2 Дж/(моль·К);
166,2 Дж/(моль·К); 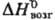 139,3 кДж/моль,
139,3 кДж/моль,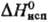 72,8 кДж/моль,
72,8 кДж/моль, 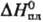 62,3 кДж/моль (см. также табл.); ур-ние
температурной зависимости давления пара: для твердого в-ва lgp(атм) =
11,510-7065/T(498-588 К), для жидкого lgp(атм) = 5,962-3810/T(588-630
К). Образует дигидрат; раств. в воде с образованием рениевой к-ты HReO4
[D
62,3 кДж/моль (см. также табл.); ур-ние
температурной зависимости давления пара: для твердого в-ва lgp(атм) =
11,510-7065/T(498-588 К), для жидкого lgp(атм) = 5,962-3810/T(588-630
К). Образует дигидрат; раств. в воде с образованием рениевой к-ты HReO4
[D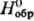 — 763,4
кДж/моль,
— 763,4
кДж/моль, 158,4
ДжДмоль·К)], в этаноле, ацетоне, пиридине. При 300 °С восстанавливается
Н2 до ReO2. Получают окислением Re, его низших оксидов
и сульфидов кислородом при т-рах выше 200 °С. Оксид Re2O7-пpoмe-жут.
соединение при получении Re.
158,4
ДжДмоль·К)], в этаноле, ацетоне, пиридине. При 300 °С восстанавливается
Н2 до ReO2. Получают окислением Re, его низших оксидов
и сульфидов кислородом при т-рах выше 200 °С. Оксид Re2O7-пpoмe-жут.
соединение при получении Re.
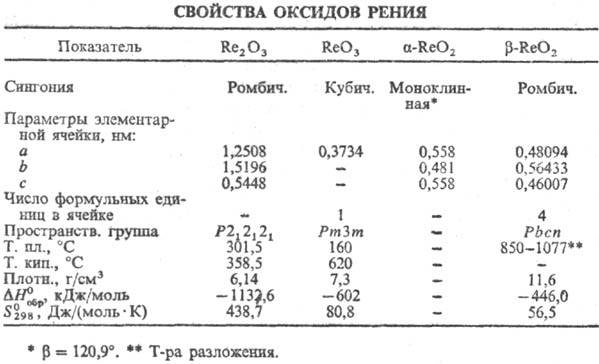
Триоксид ReO3-темно-красные
кристаллы с металлич. блеском; ур-ние температурной зависимости давления пара
для твердого в-ва lgp(атм) = 15,16-10882/Т (598-693 К); имеет проводимость
металлич. типа, r 0,018 Ом·см.(25 °С). На воздухе устойчив до 110°С,
при повыш. т-рах окисляется кислородом до Re2O7. В вакууме
при 400-537 °С диссоциирует: ReO3 (тв) : ReO2
(тв) + Re2O7 (газ) + 214,6 кДж/моль. Не раств. в воде,
разб. р-ре NaOH и горячей соляной к-те. С конц. HNO3 образует HReO4.
Образует рениевые оксидные бронзы AxReO3, где А-чаще
всего однозарядный катион. Получают ReO3 нагреванием смеси Re и Re2O7
в инертной атмосфере при 200-250 °С. ReO3 образуется при
действии на Re2O7 диоксана.
Диоксид ReO2-серовато-черные
кристаллы; при получении ReO, ниже 300 °С образуется a-модификация,
к-рая выше 300 °С необратимо переходит в b-модификацию; обе формы обнаруживают
металлич. тип проводимости; для b-ReO2 r 10-4
Ом·см (300 °С); ур-ние температурной зависимости давления пара для твердого
в-ва lgp(атм) = = 11,65-14347/T (923-1058 К); в интервале 850-1077°С
в вакууме ReO2 распадается: 7/2ReO2 (тв) : 3/2Re
(тв) + + Re2O7 (газ) + 387,0 кДж/моль. ReO2
легко окисляется HNO3, H2O2, хлорной и бромной
водой до HReO4. При растворении ReO2 в конц. соляной к-те
образуется гекса-хлороренат-анион [ReCl6]2-. При сплавлении
со щелочами на воздухе образуются соли HReO4-peнаты(VII), или пер-ренаты,
MReO4, а в вакууме-ренаты(IV, VI) (соли несуществующих к-т Re) M2ReO3
и M2ReO4. Водород выше 500 °С восстанавливает ReO2
до металла. Получают ReO2 восстановлением высших оксидов водородом
или длит. нагреванием Re с Re2O7 при 600-650 °С, а
также прокаливанием NH4ReO4 при 400 °С в инертной
атмосфере.
Оксид рения(V) Re2O5-темно-синее
твердое в-во, образующееся при действии FeSO4 на р-р к.-л. соед.
Re(VII) в конц. H2SO4; м. б. также получен электрохим.
восстановлением ренатов(VII)
в сернокислом р-ре; разлагается выше 250 °С.
Сесквиоксид Re2O3
образуется в виде тригидрата при гидролизе Re3Cl9 без
доступа воздуха; неустойчив; на воздухе легко окисляется до ReO2.
Имеются сообщения об оксидах ReO и Re2O. Ренаты(VII)-промежут. соединения
при получении Re.
Лит.: Oppermann
H., "Z. anorg. und allg. Chem.", 1985, Bd 523, № 4, S.
135-44. А. В. Штеменко.


