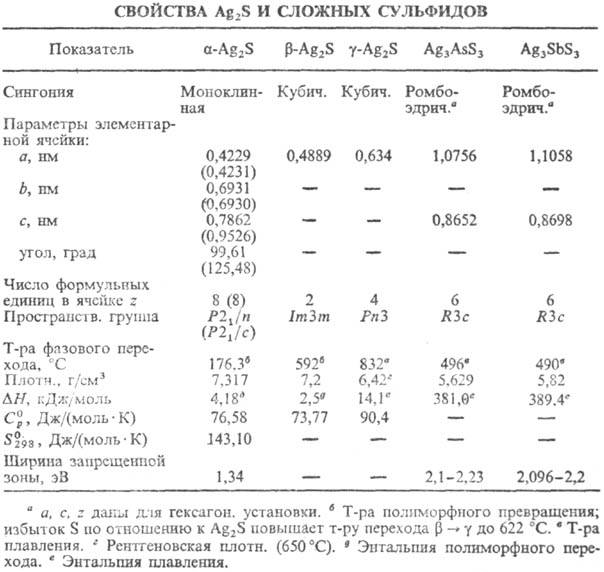
СЕРЕБРА СУЛЬФИД Ag2S,
серо-черные кристаллы; существует в трех модификациях (см. табл.)-фазах переменного
состава; область гомогенности для b-Ag2S ~ 33,31 — 33,33 ат.
% S (177 °С), для g-Ag2S - 32,36 - 37,04 ат.% S (727 °С).
Практически не раств. в воде, орг. р-рителях, водном аммиаке, разлагается водным
р-ром KCN или царской водкой. При нагр. в вакууме диссоциирует на Agтв
и пары S, ур-ние температурной зависимости давления пара S lgp(мм рт.
ст.) = — 13082/Т + 9,24. При нагр. на воздухе окисляется, a-Ag2S-полупроводник;
фоточувствителен; подвижность электронов 63,5 см2/(В·с), дырок 19,0
см2/(В·с); r 1000 Ом·см; коэф. термоэдс —1000 мкВ/К; теплопроводность
7,52 Вт/(см·К). b-Ag2S имеет r 10-3 Ом·см; коэф.
термоэдс — 60 мкВ/K.
С. с. встречается в природе
в виде минералов акантита a-Ag2 S и аргентита b-Ag2
S.
С. с. получают взаимод.
Ag с S либо в вакуумир. кварцевых ампулах, либо р-цией расплавл. или твердого
Ag с парами S или с парами S в потоке Аr, N2, а также осаждением
сероводородом из водного р-ра AgNO3.
Сложные С.с.-соед. Ag2S.c
сульфидами As, Sb, Bi, Si, Ge, Ga, In и др. Наиб. важны из них тритиоантимонат
Ag3SbS3 (темно-малиновые кристаллы) и тритиоарсе-нат Ag3AsS3
(красные кристаллы); не раств. в воде и орг. р-рителях; получают сплавлением
Ag2S с Sb2S3 (или As2 S3)
либо Ag с S и Sb (As). Встречаются в природе в виде минералов пираргирита Ag3SbS3
и прустита Ag3AsS3.
Применяют Ag2S
как компонент твердых электролитов, полупроводниковых материалов, для осаждения
Ag+ из р-ров; Ag3SbS3 и Ag3AsS3-
материалы для электрооптич. и электроакустич. устройств. Руды, содержащие акантит,
аргентит, прустит, пираргирит,-сырье для получения Ag.
Лит.: Самсонов Г.
В., Дроздова С. В., Сульфиды, М., 1972, с. 38-41; Полупроводниковые халькогениды
и сплавы на их основе, М., 1975; Вапю-ков А. В., Исакова Р. А., Быстрое В. П.,
Термическая диссоциация сульфидов металлов, А.-А., 1978. И. Н. Один.


