СТОРКА РЕАКЦИЯ,
a-алкилирование (a-ацилирова-ние) кетонов или альдегидов последоват.
действием на них вторичными аминами (с образованием енаминов), алкилирующими
(ацилирующими) агентами и Н2О, напр.:
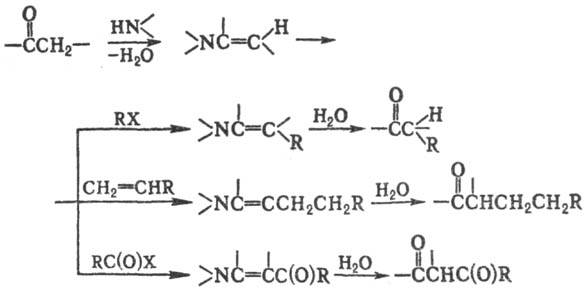
Р-цию проводят в орг. р-рителе
(напр., диоксане, ацето-нитриле) при нагревании. Образующиеся продукты гидро-лизуют
в присут. к-т.
Для получения енаминов
обычно используют пирроли-дин, морфолин или пиперидин, в качестве алкилирующих
(ацилирующих) агентов-активир. олефины, эпоксиды, a-га-логензамещенные
простые и сложные эфиры, кетоны и нитрилы; первичные или вторичные алкилгалогениды
обычно одновременно с С-алкилированием осуществляют N-алки-лирование, третичные
алкилгалогениды в условиях С. р. образуют олефины (установлено, что первичные
алкилгалогениды гладко алкилируют по атому С енамины, полученные из бутилизобутиламина
и альдегидов, а нек-рые активир. арилгалогениды, напр. 2,4-динитрохлорбензол,
сравнительно легко арилируют ряд енаминов). При вовлечении в С. р. несимметрично
замещенных циклич. кетонов алкилирование обычно идет с той стороны карбонильной
группы, где меньше заместителей в цикле. Продукты алкилирования в ходе р-ции
иногда претерпевают циклизацию. Выходы продуктов алкилирования при использовании
олефи-нов (обычно эфиров акриловой к-ты, акрилонитрила, метилвинилкетона, нитроэтилена)
ок. 85%, в др. случаях 45-70%.
Типичные ацилир. агенты
в C.p.-RC(O)Hal (R = Alk, Ar, Hal = Cl, Br), ангидриды низших карбоновых к-т,
изоцианаты, кетены и изотиоцианаты; применяют также С(O)Сl2, ClC(O)OR,
HalC(O)C(O)Hal, ClCN, RSO2Cl и др. Выходы 50-70%. При использовании
RC(O)Hal аци-лирование иногда ведут в присут. N(C2H5)3
или избытка енамина.
Нек-рые р-ции ацилирования
на ключевой стадии показаны на схеме:
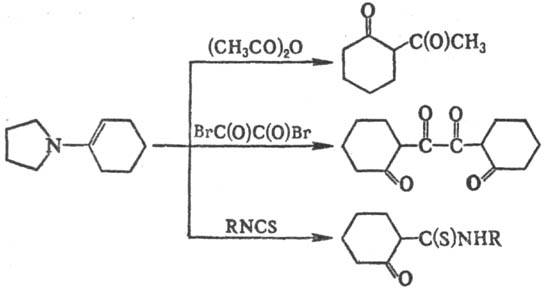
Образующиеся при ацилировании
b-дикетоны используют в синтезе кетокислот и дикетодикарбоновых к-т. Механизм
ключевой стадии включает след. превращения:
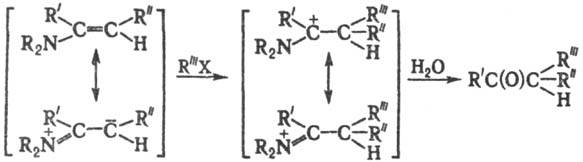
Модификации С. р.: алкилирование
солей енаминов, к-рые синтезируют обработкой иминов С2Н5
MgBr в ТГФ, а также алкилирование литийенаминов с помощью RHal и послед. гидролиза
промежут. продукта:
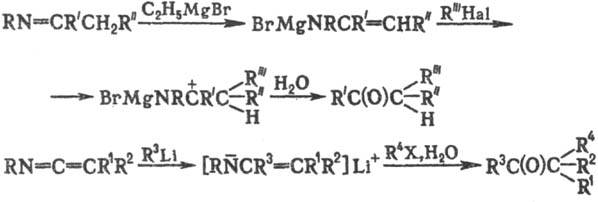
С. р. используют в препаративной
практике, она открыта Г. Сторком, Р. Терреллом и Дж. Шмушкевичем в 1954.
Лит.: Марч Дж.,
Органическая химия, пер. с англ., т. 2, М., 1987, с. 442-45; Enamines: synthesis,
structure and reactions, ed by A.G. Cook, N.Y., 1969.
Г.И. Дрозд.


