ТИИЛЬНЫЕ РАДИКАЛЫ,
соед. общей ф-лы RS•(R-H, орг. или неорг. остаток); высокореакционноспособные
соед., в своб. виде не выделены. Неспаренный электрон на атоме S находится на
высшей связывающей мол. орбитали, что обусловливает электроф. св-ва. Т. р. обладают
большим сродством к электрону, чем оксильные радикалы RO•, и в отличие
от них легко рекомбинируют при низких т-рах. Для простейшего Т. p. HS•
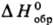 133,56-146,54
кДж/моль; у алкилтиильных
радикалов
133,56-146,54
кДж/моль; у алкилтиильных
радикалов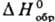 понижается
с ростом длины и разветвленности
алкильной цепи и составляет для CH3S• 129,8 кДж/моль,
для C4H9S• 62,8 кДж/моль, для (CH3)2CS•
46,05 кДж/моль; для PhS•
понижается
с ростом длины и разветвленности
алкильной цепи и составляет для CH3S• 129,8 кДж/моль,
для C4H9S• 62,8 кДж/моль, для (CH3)2CS•
46,05 кДж/моль; для PhS•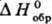 213,53
кДж/моль.
213,53
кДж/моль.
Т. р. стабилизируются электронодонорными
и дестабилизируются электроноакцепторными заместителями.
В спектрах ЭПР Т. р. наблюдается
одиночная линия, для AlkS• g-фактор 2,0074, для PhS* 2,008;
при введении изотопа 33S-квартетное расщепление, константы
сверхтонкого взаимод. = 1,475 мТл.
Величина g-фактора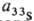 (параллельного)
для AlkS• составляет 2,158 и м. б. использована для их идентификации.
Величины g-факторов (перпендикулярного и параллельного) для PhS•
(генерирован при УФ облучении PhSSPh) соотв. 2,006 и 2,012 при — 200 °С.
Для идентификации Т. р. используют также спиновых ловушек метод.
(параллельного)
для AlkS• составляет 2,158 и м. б. использована для их идентификации.
Величины g-факторов (перпендикулярного и параллельного) для PhS•
(генерирован при УФ облучении PhSSPh) соотв. 2,006 и 2,012 при — 200 °С.
Для идентификации Т. р. используют также спиновых ловушек метод.
Т. р. присоединяются к
кратным связям и отрывают атом H от молекул орг. соединений. Скорость этих
процессов зависит от полярных эффектов вследствие высокого сродства Т. р. к
электрону и от прочности образующейся связи S—Н. Р-ция отрыва атома H (RS•
+ HR' : RSH + •R') чувствительна к стерич. затруднениям в молекулах
и радикалах.
Наиб. подробно изучены
св-ва Т. р. в р-циях присоединения к непредельным соединениям. Т. р. атакуют
центр с наиб. электронной плотностью в молекуле замещенного этилена и присоединяются
к ней против правила Марков-никова; р-ция протекает по цепному механизму:
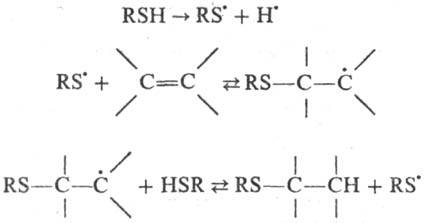
Последние 2 р-ции экзотермичны,
что способствует быстрому развитию цепи.
Т. р., генерируемые термически
из H2S и его производных, замещают атом галогена в галогенаренах
и галогенолефи-нах, напр.:
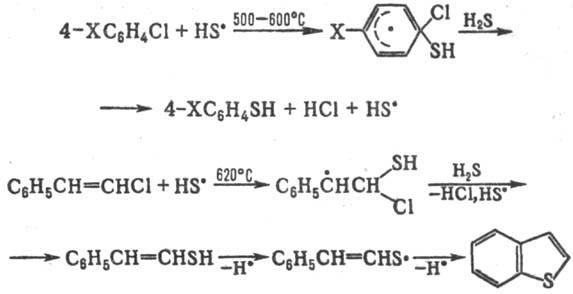
"Ловушками"
Т. р. в термин, процессах могут служить также ацетиленовые соединения.
Образуются Т. р. при фотолизе,
радиолизе и термолизе H2S и его производных (тиолов, сульфидов, дисульфидов,
тионитритов и др.), а также при действии на эти соед. инициаторов (пероксидов,
диазосоед. и др.).
Используют Т. р. в качестве
регуляторов радикальной полимеризации и процессов пиролиза углеводородов. Они
инициируют термич. превращения соед. др. типов и применяются в орг. синтезе.
Лит.: Уоллинг Ч.,
Свободные радикалы в растворе, пер. с англ., М., 1960; Нонхибел Д., Уилтон Дж.,
Химия свободных радикалов, пер. с англ., М., 1977; Воронков М. Г., Дерягина
Э. Н., "Успехи химии", 1980, т. 59, в. 8, с. 1338; Гасанов Р. Г.,
Фрейдлина Р. X., там же, 1987, т. 56, в. 3, с. 477.
М. Г. Воронков.


