ТРИФТОРНИТРОЗОМЕТАН
CF3NO, мол. м. 99,01; газ синего цвета
с резким запахом гнили; т. пл.-196,6 0C, т. кип. -84 0C;
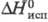 16,84
кДж/моль; плохо раств. в воде, хорошо -
в орг. р-рителях. Длины связей в молекуле T. (нм) 0,1546 (C-N), 0,1326 (C-F),
0,1197 (N=O), углы CNO 113,2°, NCF 109,0°.
16,84
кДж/моль; плохо раств. в воде, хорошо -
в орг. р-рителях. Длины связей в молекуле T. (нм) 0,1546 (C-N), 0,1326 (C-F),
0,1197 (N=O), углы CNO 113,2°, NCF 109,0°.
T. устойчив к гидролизу
в нейтральных и кислых средах; под действием щелочей или при нагр. в присуг.
активир. угля диспропорционирует:
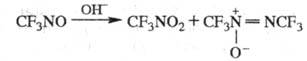
При УФ облучении T. димеризуется:
CF3NO (CF3)2NONO.
При окислении образует трифторнитрометан, при восстановлении - трифторметилгидроксиламин
CF3NHOH, с аминами дает азосоединения
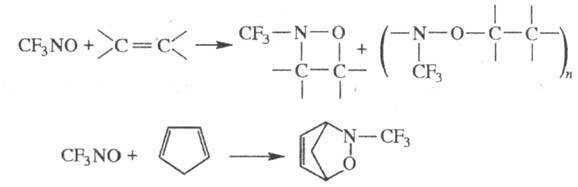
CF3N =NR (R = H, Alk, Ar). Легко вступает в р-ции циклоприсоединения,
образуя с алкенами смесь [2 + 2]-циклоаддуктов (оксазетидинов)
и линейных сополимеров, а с диенами - [2 + 4]-циклоаддукты:
(CF3)2NONO.
При окислении образует трифторнитрометан, при восстановлении - трифторметилгидроксиламин
CF3NHOH, с аминами дает азосоединения
CF3N =NR (R = H, Alk, Ar). Легко вступает в р-ции циклоприсоединения,
образуя с алкенами смесь [2 + 2]-циклоаддуктов (оксазетидинов)
и линейных сополимеров, а с диенами - [2 + 4]-циклоаддукты:
Получают T. фотолизом смеси
CF3I (или CF3Br) и NO в присут. Hg; пиролизом трифторацетилнитрита;
взаимод. трифгорметана с ClNO при УФ облучении; фторированием AgCN или дициана;
разложением трифторацетилгидроксамо-вой к-ты.
Т.- мономер для получения
термо- и химически стойких высокоэластичных фторнитрозокаучуков.
При вдыхании обладает удушающим
действием, раздражает слизистые оболочки глаз и дыхат. путей.
Лит.: Кнунянц И.Л.,
Сизов Ю.А., Ухаров О.В., "Успехи химии", 1983,
т. 52, в. 6, с. 976-1017; Gmelins Handbuch der anorg. Chem., 8 Aufl., Syst.
№ 5, Tl 7, Perfluorhalogenorgano-VeAindungen der Hauptgruppenelemente, В.- [и.
а.], 1979, S. 151-73. И. И. Крылов.


