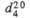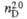ТРИФТОРУКСУСНАЯ КИСЛОТА
CF3COOH, мол.м. 114,03; бесцв. дымящая на воздухе жидкость с
острым раздражающим запахом; т. пл. -15,3 0C, т. кип. 72,4 0C;
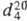 1,489;
1,489;
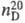 1,2850;
tкрит 218,15 0C, ркрит 3,26 МПа,
1,2850;
tкрит 218,15 0C, ркрит 3,26 МПа,
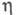 1,225
мПа·с (О 0C), 0,877 мПа·с (20 0C);
1,225
мПа·с (О 0C), 0,877 мПа·с (20 0C); 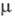 7,6·10-30
Кл·м;
7,6·10-30
Кл·м; 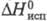 34,21 кДж/моль,
34,21 кДж/моль, 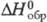 -1020 кДж/моль;
-1020 кДж/моль;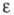 8,55
(20 0C); рКа 0,558 (25 0C, вода).
8,55
(20 0C); рКа 0,558 (25 0C, вода).
Смешивается с водой и орг.
р-рителями во всех соотношениях, с водой образует азеотропную смесь (т. кип.
105,46 0C, 79,4% по массе T. к.). С диалкиловыми эфирами, кетонами,
карбоновыми к-тами и др. электронодонорными соед. дает прочные
комплексы.
СВОЙСТВА НЕКОТОРЫХ ПРОИЗВОДНЫХ
ТРИФТОРУКСУСНОЙ КИСЛОТЫ
|
Соединение |
Мол. м. |
T. пл., :С |
T. кип., 0C |
|
|
|
Трифторацетилхлорид CF3COCl |
132,47 |
— |
18,5 |
— |
— |
|
Трифторацетангидрид (CF3CO)2O |
210,03 |
-65,0 |
38,8-39 |
1,495* |
1,2680* |
|
Этилтрифторацетат
CF3COOC2H5 |
142,03 |
— |
61,0 |
1,464 |
1,2772 |
|
Трифторацетамид
CF3CONH2 |
113,04 |
74,8 |
162,5 |
— |
— |
|
Трифторацетонитрил
CF3CN |
95,02 |
-100 |
-63 |
— |
— |
* При 25 0C.
Термически стабильна, не
разлагается при нагр. до 400 0C. По
хим. св-вам - типичная карбоновая кислота. Свойства производных T. к.
см. в таблице.
Т.к. легко присоединяется
по кратным связям алке-нов, циклоалкенов, ацетиленов с образованием трифтораце-татов;
с галогенами дает малоустойчивые гипогалогениты CF3COOHaI, к-рые
селективно галогенируют разл. соед.; при нагр. Ag-соли T. к. с избытком I2
образуется трифторметилио-дид; при восстановлении T. к. и ее эфиров LiAlH4
при О 0C -трифторацетальдегид, а при избытке восстановителя при 30
0C - 2,2,2-трифторэтанол. Р-ция с многоатомными спиртами (напр.,
с триолами) приводит к полициклич. ортоэфи-рам, напр.:
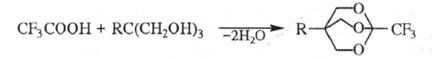
При действии P2O5
на T.к. образуется трифторацет-ангидрид- сильный ацилирующий агент; при взаимод.
со спиртами Т.к. дает сложные эфиры, с аминами - амиды, с карбоновыми к-тами
- смешанные ангидриды. Последние, а также (CF3CO)2O в
присут. минер. K-T или сульфокислот используют в качестве промоторов при ацилировании
спиртов, фенолов, тиолов, напр.:
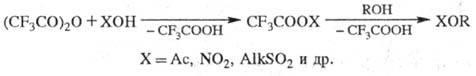
Алкены и нек-рые ароматич.
соед. в этих условиях образуют кетоны, напр.:
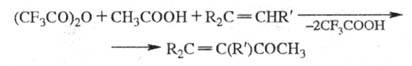
В пром-сти Т.к. получают
электрохим. фторировани-ем ангидрида или фторангидрида уксусной к-ты в безводном
HF с послед, гидролизом образующегося фторангидрида T. к.
Т.к. может быть получена
также кислотным гидролизом 1,1,1-трифтортрихлорэтана, окислением хлоролефинов,
содержащих группу CF3, или 2,2,2-трифгорэтанола:
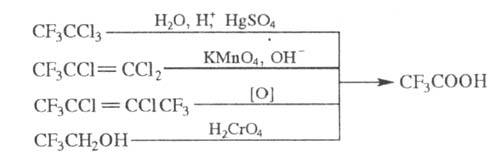
T. к.- сырье в орг. синтезе,
катализатор в р-циях этерифи-кации и полимеризации, р-ритель для ряда термостойких
полимеров. Трифгорацетангидрид применяют в произ-ве ацетатного шелка (США, Великобритания),
фармацевтич. препаратов, пестицидов, в качестве реагента для защиты функц. групп
в синтезе пептидов.
T. к.- трудногорюча, невзрывоопасна.
В жидком виде и в парах вызывает сильные ожоги кожных покровов и слизистых оболочек.
ПДК в воздухе рабочей зоны 2 мг/м3.
Лит.: Физер Л.,
Физер M., Реагенты для органического синтеза, пер. с англ., т. 3, M., 1970;
Исикаве H., Кобаяси Ё., Фтор. Химия и применение, пер. с япон., M., 1982; Промышленные
фторорганические продукты. Справочник, Л., 1990, с. 367-71. И. И. Крылов.