ТРОМБИН (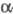 -тромбин),
фермент класса гидролаз (серино-вая протеаза), катализирующий гидролиз пептидных
связей, образованных остатками аргинина и лизина (обладает ограниченной субстратной
специфичностью).
-тромбин),
фермент класса гидролаз (серино-вая протеаза), катализирующий гидролиз пептидных
связей, образованных остатками аргинина и лизина (обладает ограниченной субстратной
специфичностью).
T. играет ключевую роль
в системе свертывания крови -катализирует превращение фибриногена в фибрин,
осуществляет активацию разл. факторов свертывания крови. (см. Протромбиновый
комплекс), стимулирует активацию тромбоцитов, эндотелиальных (выстилают
внутр. стенки кровеносных и лимфатич. сосудов, полостей сердца) и гладкомышечных
клеток. T. проявляет также неферментативные (гормо-ноподобные) св-ва - связывается
с рецепторами лейкоцитов, стимулируя хемотаксис (направленное движение клеток,
обусловленное градиентом концентрации хим. B-B).
T. вовлекается в процессы
заживления ран, функционирует как сильное ангиогенное (воздействующее на кровеносные
сосуды) и митогенное (стимулирует деление клеток) ср-во; участвует в разл. патологич.
процессах, таких, как тромбозы, атеросклероз, рак и др.
Молекула T. человека (мол.
м. ок. 40 тыс.) состоит из двух пептидных цепей (А и Б), содержащих соотв. 36
и 259 аминокислотных остатков, связанных одной дисульфидной связью. Каталитич.
участок активного центра фермента расположен в Б цепи, аминокислотная последовательность
к-рой гомологична структуре трипсина, химотрипсина и эластазы (фермент, катализирующий
гидролиз белка эластина -компонента волокна соединит. ткани). Каталитич. центр
T. содержит характерный для сериновых протеаз фрагмент  (букв. обозначения см. в ст. Аминокислоты).
(букв. обозначения см. в ст. Аминокислоты).
Молекула T. содержит два
анионсвязывающих участка, один из к-рых расположен вблизи каталитич. центра
и ответствен за "узнавание" фибриногена. Со вторым связываются гепарин
и др. полисахариды, а также гирудин (белок, вырабатываемый слюнными железами
мед. пиявок; состоит из 65 аминокислотных остатков) и клеточные мембраны.
Неполярный участок связывания,
расположенный вблизи каталитич. центра Т., обусловливает преим. расщепление
ферментом субстратов, содержащих пептидные связи, образованные аргинином и лизином,
непосредственно связанными с остатком пролина или с др. неполярными остатками
аминокислот. Вблизи каталитич. центра располагается уникальная аминокислотная
последовательность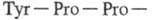
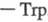 , к-рая обеспечивает хемотоксич. св-ва T. в отношении лейкоцитов. Аминокислотная
последовательность
, к-рая обеспечивает хемотоксич. св-ва T. в отношении лейкоцитов. Аминокислотная
последовательность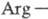
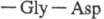 участвует в связывании T. с клеточными рецепторами. Кроме того, T. содержит
углеводную компоненту, функцион. роль к-рой не выяснена.
участвует в связывании T. с клеточными рецепторами. Кроме того, T. содержит
углеводную компоненту, функцион. роль к-рой не выяснена.
T. образуется из протромбина
в результате его активации. Ингибиторы Т.- белки плазмы крови антитромбин III
(мол. м. ок. 65 тыс.),  -макроглобулин
(мол. м. ок. 725 тыс.) и нек-рые др.; наиб. ингибирующим действием обладает
ги-рудин.
-макроглобулин
(мол. м. ок. 725 тыс.) и нек-рые др.; наиб. ингибирующим действием обладает
ги-рудин.
Лит.: Овчинников
Ю.А., Биоорганическая химия, M., 1987, с. 233-34; Fenton J. W. П, "Seminars
of Thrombosis and Hemostasis", 1988, № 14, p. 234-40; там же, 1989, №
15, p. 265-68. И. П. Баскова.


