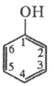
ФЕНОЛ (гидроксибензол,
карболовая к-та), мол.м. 94,11; бесцв., розовеющие на воздухе кристаллы с характерным
запахом; т. пл. 40,8 0C, т. кип. 181,84 0C, 70,9 °С/10
мм рт.ст.; 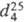 1,132,
1,132, 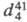 (жидкость) 1,0576;
(жидкость) 1,0576;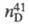 1,5509; ркрит 6,11 МПа; tкрит 419
0C; h 2,47·10-6 (60 0C) и 1,56·10-6
м2/с (80 0C); g 0,03766 Н/м (50 0C); m
4,736·10-30 Кл·м;
1,5509; ркрит 6,11 МПа; tкрит 419
0C; h 2,47·10-6 (60 0C) и 1,56·10-6
м2/с (80 0C); g 0,03766 Н/м (50 0C); m
4,736·10-30 Кл·м; 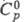 132,7 Дж/(моль·К);
132,7 Дж/(моль·К);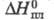 11,5 кДж/моль;
11,5 кДж/моль;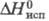 45,923 кДж/моль;
45,923 кДж/моль;  68,594 кДж/моль (25 0C);
68,594 кДж/моль (25 0C); 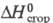 -3051,8 кДж/моль;
-3051,8 кДж/моль; 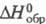 -162,944
кДж/моль; e
11,60 (жидкость, 40 0C), 2,83 (кристаллы, 20 0C). Ф.-
слабая к-та, рКа 9,98 (вода, 25 0C). Хорошо раств. в этаноле,
диэтиловом эфире, ацетоне, CHCl3 и др. орг. р-рителях, умеренно -в
воде (6,7 г в 100 мл при 16 0C), при т-ре выше 66 0C раств.
в воде в любом соотношении. Образует двухкомпонент-ные азеотропные смеси, напр,
с H2O (т. кип. 99,6 0C, 9,2% по массе Ф.), кумолом (т.
кип. 170,5 0C, 37% Ф.), анилином (т. кип. 186,22 0C, 42%
Ф.) и трехкомпонентные азеотропные смеси, напр, с H2O и кумолом (т.
кип. 134,3 0C, 79,5% Ф., 20,33% H2O и 0,17% кумола).
-162,944
кДж/моль; e
11,60 (жидкость, 40 0C), 2,83 (кристаллы, 20 0C). Ф.-
слабая к-та, рКа 9,98 (вода, 25 0C). Хорошо раств. в этаноле,
диэтиловом эфире, ацетоне, CHCl3 и др. орг. р-рителях, умеренно -в
воде (6,7 г в 100 мл при 16 0C), при т-ре выше 66 0C раств.
в воде в любом соотношении. Образует двухкомпонент-ные азеотропные смеси, напр,
с H2O (т. кип. 99,6 0C, 9,2% по массе Ф.), кумолом (т.
кип. 170,5 0C, 37% Ф.), анилином (т. кип. 186,22 0C, 42%
Ф.) и трехкомпонентные азеотропные смеси, напр, с H2O и кумолом (т.
кип. 134,3 0C, 79,5% Ф., 20,33% H2O и 0,17% кумола).
По хим. св-вам Ф.- типичный
представитель фенолов; первый член ряда. При взаимод. с щелочами MOH
Ф. образует соли - феноляты ф-лы C6H5OM. Взаимод. C6H5ONa
с диме-тилсульфатом приводит к простому эфиру Ф.- анизолу. Сложные эфиры
образуются при натр. Ф. с хлорангидридами к-т в присут. третичных аминов или
с р-ром NaOH (р-ция Шотте-на - Баумана). По Кольбе - Шмитта реакции Ф.
при действии NaOH и CO2 превращается в салициловую к-ту, при действии
KOH и CO2 - в п-гидроксибензойную. Аммонолиз Ф. при 300-600
0C и давлении выше 1,5 МПа (кат. Al2O3 или
алюмосиликат) приводит к анилину.
Р-ции электроф. замещения
протекают по орто- и пара-положениям. Так, нитрование Ф. конц.
HNO3 приводит к 2,4,6-тринитрофенолу (пикриновой к-те), бромирование
Br2 - к 2,4,6-трибромфенолу, сульфирование - к смеси о- и
п-фенолсульфокислот, алкилирование алкилгалогенидами, олефинами или спиртами
в присут. кислых катализаторов -к смеси о- и п-алкилфенолов. Ф.
легко конденсируется с карбонильными соед., образуя, напр., с формальдегидом
фе-ноло-формальдегидные смолы, с ацетоном - бисфенол А [2,2-бмс-(4-гидроксифенил)пропан],
с фталевым ангидридом - фенолфталеин. Окисление Ф. O2 воздуха или
персульфатом К в щелочной среде приводит к гидрохинону. При действии
LiAlH4 при 350 0C F. превращается в бензол, в условиях
жидкофазного гидрирования в присут. Ni- и Pd-ка-тализаторов - в циклогенсанол.
Последний (с примесью цик-логексанона) образуется также при газофазном гидрировании
Ф. в присут. металлов VIII гр. (напр., Pd/Al2O3, 120-140
0C, 1-1,5 МПа; Ni-Ренея, 150 0C, 1-2 МПа; Fe-Cr, 100-120
0C, 1-2 МПа).
В пром-сти Ф. синтезируют
преим. окислением кумола O2 воздуха при 90-130 0C в присут.
щелочных добавок с послед, разложением образующегося гидропероксида кумола (т.
наз. кумольный метод, или метод Удриса - Сергеева) по р-ции:
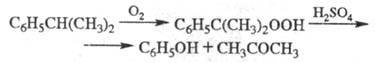
Выход Ф. ок. 96% в расчете
на кумол; выделяют Ф. и ацетон ректификацией. Побочные продукты - a-метилстирол
и аце-тофенон, от примесей к-рых (окись мезитила, 2-метилбензо-фуран и др.)
Ф. очищают на катионитах или обработкой H2SO4.
Другие пром. способы синтеза
Ф.: 1) Окисление толуола
O2 воздуха в бензойную к-ту (150-170 0C, 1,5 МПа, кат.-
Со) с послед, окислит, декарбо-ксилированием (230-240 0C, кат.- Cu)
до Ф. (толуольный метод, выход 82%). 2) Окислит, гидрохлорирование бензола (270
0C, кат.- оксиды Fe и Cu) с послед, гидролизом образующегося хлорбензола
водяным паром при 450-550 0C, кат.- SiO2 (хлорбензольный
метод Хугера - Рашига, выход 90-95%). 3) Сульфирование бензола H2SO4
(120-150 0C, 0,25 МПа) с послед, щелочным плавлением образующейся
бензолсульфокислоты с NaOH при 320 0C (сульфурационный метод, выход
92%). 4) Окисление циклогексана O2 воздуха (130-160 0C,
3-4 МПа, кат.-соли Со) в смесь циклогексанола и циклогексанона с послед, дегидрированием
при 250—420 0C, кат.- Со, Pt или Ni (цик-логексановый метод, выход
95%).
Для обнаружения Ф. используют
цветные р-ции, напр., с r-ром FeCl3 (фиолетовое окрашивание,
исчезающее при под-кислении), бромной водой (появление белого осадка); для идентификации
Ф.- кристаллич. производные Ф., напр, фе-ноксиуксусную к-ту (т. пл. 98-99 0C).
Количественно Ф. определяют иодометрией, бромометрией или ГЖХ.
Ф.- антисептич. и дезинфицирующее
ср-во (карболка черная). Применяют Ф. для произ-ва разл. фенольных смол (феноло-альдегидных,
резольных), e-капролактама, адипино-вой к-ты, анилина, бисфенола А, алкилфенолов,
пестицидов, пластификаторов; Ф. используется в синтезе многих лек. ср-в, напр,
аспирина, салола, фенолфталеина.
T. всп. 79 0C
(в закрытом тигле), 85 0C (в открытом); т. самовоспл. 595 0C;
КПВ 0,3-2,4%.
Ф. вызывает нарушение функций
нервной системы, дыхания и кровообращения, раздражает слизистые оболочки ды-хат.
путей и глаз, вызывает ожоги при попадании на кожу. ПДК в атм. воздухе 0,003
мг/м3, в воздухе рабочей зоны 0,3 мг/м3, в воде водоемов
рыбохозяйственного и хозяйств.-бытового пользования 0,001 мг/л. ЛД50
427 мг/кг (мыши, внутрижелудочно).
Мировой объем произ-ва
4,7 млн. т в год (1985); объем произ-ва в США 1,59 млн. т в год (1990).
Лит. см. при ст.
Фенолы. И. Д. Синович, Г. П. Павлов.


