ФОСФАТЫ НЕОРГАНИЧЕСКИЕ,
соли кислородных к-т фосфора в степени окисления +5 (см. Фосфора кислоты).
Существуют ортофосфаты - соли ортофосфорной к-ты H3PO4
и фосфаты конденсированные - соли полифосфорных к-т. Различают средние,
кислые и основные фосфаты, разнокатион-ные (двойные и тройные соли) и разноанионные
(смешанные соли), оксифосфаты, а также разл. неорг. производные (напр., тиофосфаты).
Анионы Ф. н. построены из тетраэдров PO4 с атомами О в вершинах.
Ортофосфаты состоят из изолированных
тетраэдров, в конденсированных Ф. н. тетраэдры связаны в кольца или цепочки
через общие вершины.
Кислые Ф. н. образуются
в результате частичной нейтрализации H3PO4 или полифосфорных
к-т основаниями. При полной нейтрализации гидроксидами одного или неск. металлов
получают средние Ф. н.- соотв. одного металла или двойные Ф. н. Смешанные соли
образуются при нейтрализации смеси к-т, напр. ди- и трифосфорных, одним гидроксидом
(ординарные разноанионные Ф. н.) или неск. гидроксидами (разнокатионно-разноанионные
Ф. н.). Нейтрализующим агентом служит и NH3. Конденсированные Ф.
н. получают также термич. обработкой кислых Ф. н., смесей Ф. н. При этом состав
исходного продукта (в пересчете на оксиды) 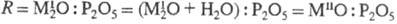 должен отвечать составу синтезируемого соединения (О < R
должен отвечать составу синтезируемого соединения (О < R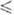 3).
В области значений 3 < R
3).
В области значений 3 < R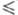 8
получают оксифосфаты. Характеристики нек-рых Ф. н. приведены в таблице.
8
получают оксифосфаты. Характеристики нек-рых Ф. н. приведены в таблице.
Ортофосфаты встречаются
в природе в виде минералов (известно ок. 190), важнейшие из них - апатит
и фосфориты (см. также Фосфор).
Средние Ф. н. Общее
св-во безводных солей - стабильность при нагр. до т-ры плавления. Ортофосфаты
МII3(РО4)2 плавятся при 1375 (M
= Mg), 1777 (Ca), 1600 (Sr), 1605 (Ba), 1152 (Mn), 1345 (Ni), 1060 (Zn), 1014
0C (Pb), дифосфаты MII2P2O7
- при 1382 (Mg), 1355 (Ca), 1375 (Sr), 1430 (Ba), 1195 (Mn), 1400 (Ni), 1020
(Zn), 830 0C (Pb). Исключение составляют неустойчивые Ф. н. (с катионами
NH+4, Hg2+), напр. Hg3(PO4)2,
из к-рого часть ртути улетучивается ниже т-ры плавления. В противоположность
ортофосфатам конденсированные Ф. н. Pn при плавлении превращаются
в фосфатные смеси Рт.
Кристаллогидраты мн. ортофосфатов
и нек-рых конденсированных Ф. н. при нагр. теряют кристаллизационную воду ступенчато
без изменения состава аниона. На этом св-ве основан топохим. способ синтеза
безводных солей, к-рые не удается получить др. способами. Так, топохим. путем
из (NH4)5P3O10·хH2O,
где х=I, 2, в среде газообразного NH3 получен кристаллич.
(NH4)5P3O10. Средние Ф. н. металлов
в высоких степенях окисления не раств. в воде, щелочных металлов и аммония -
раств., их водные р-ры имеют рН > 7. Анионы конденсированных Ф. н. не стабильны
в водных р-рах, они последовательно превращаются в анионы низших Ф. н.
Кислые и основные Ф.
н. Р-римость в воде кислых и основных Ф. н. выше, чем у средних, в р-р переходят
даже нек-рые соли металлов в высоких степенях окисления. Благодаря этому св-ву
кислые Ф. н. используют в качестве удобрений. При рН < 7 сложные анионы быстрее
разлагаются до простых (по сравнению с рН > 7). При нагр. в результате конденсации
кислые соли меняют анионный состав ниже т-ры плавления, благодаря чему они служат
исходными соед. для получения мн. конденсированных Ф. н.
Помимо гидро- и дигидроортофосфатов
щелочных металлов известны кристаллич. кислые ортофосфаты: MIIHPO4,
где M = Be, Mg, Ca, Sr, Ba, Mn, Zn, Cd, Sn, Pb, Hg, их кристаллогидраты с одной
молекулой воды (M = Be, Mg, Cu, Zn), двумя (Ca, Со, Ni), тремя (Mg, Mn, Zn)
и семью (Mg); MII(Н2РО4)2, где M
= Mg, Sr, Ba, Cu, Cd, Sn, Pb, их кристаллогидраты с одной молекулой воды (M
= Ca, Sr), двумя (Mg, Mn, Fe, Со, Ni, Zn, Cd) и четырьмя (Mg); содержащие неск.
анионных форм: Со(Н2РО4)2·2H3PO4,
NaH2PO4·Na2HPO4 (используется при
получении триполифосфата Na). Получены дигидродифосфаты MII2H2P2O7,
где M = Ca, Sn, Ba, Mn, Fe, Со, Ni, Zn, Pb; кислые трифосфаты MI3H2P3O10·1,5H2O,
где M = Na, Rb; MII2HP3O10, где
M = Ca, Pb; MIIIH2P3O10, где M =
Al, Cr, Fe, а также их моно-, ди- и тригидраты.
Кристаллич. тригидрофосфат
K2H3P3O10·2H2O отличается
от гидро- и дигидрофосфатов способностью менять консистенцию при мех. активации
и превращаться в пластилино-подобную массу. Эффект связан с диспропорционированием,
к-рое в кислых солях разл. металлов проявляется по-разному. При вьщерживании
кристаллов MnHPO4·3H2O во влажной среде в их объеме возникают
и растут жидкие и твердые включения продуктов распада исходной кислой соли на
менее протонированную соль и свободную к-ту:
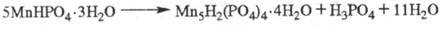
ХАРАКТЕРИСТИКА НЕОРГАНИЧЕСКИХ
ФОСФАТОВ
|
Соединение |
R |
Сингония, пространст- венная группа |
Параметры решетки |
z |
Плотн., г/см3 |
|||||||
|
а, нм |
b, мм |
c, нм |
|
|
рентгеновская |
экспериментальная |
||||||
|
Средние соли |
||||||||||||
|
Na3PO4
· 12H2O |
3 |
Тригон., Р3с1 |
1,202 |
— |
1,266 |
— |
— |
— |
— |
1,62 |
||
|
Zn3(PO4)2
·4H2O (гопеит) |
3 |
Ромбич. |
1,0629 |
1,8339 |
0,5040 |
— |
— — |
4 |
3,096 |
3,104 |
||
|
Zn5(P3O10)2·I7H2O |
5/3 |
Триклинная |
1,0766 |
1,0316 |
0,8525 |
111,39 |
115,08 70,19 |
1 |
— |
— |
||
|
Ca4P6O19
(тромелит) |
4/3 |
То же |
0,940 |
1,339 |
0,707 |
109,5 |
87,9 108,9 |
2 |
2,86 |
2,85 |
||
|
Mg2P4O12-I |
1 |
Моноклинная, C2/c |
1,1756 |
0,8285 |
0,9917 |
— |
118,96 — |
4 |
2,865 |
— |
||
|
|
1 |
Орторомбич., Р212121 |
0,7428 |
0,7360 |
0,8577 |
— |
— — |
4 |
3,83 |
— |
||
|
Ba2P6O17 |
2/3 |
Моноклинная, P21 |
0,7387 |
1,3311 |
0,7418 |
— |
105,56 — |
2 |
— |
— |
||
|
MnP4O11 |
1/2 |
Р21
/п |
0,8608 |
0,8597 |
1,2464 |
— |
— 97,30 |
4 |
— |
2,62 |
||
|
Кислые и основные
соли |
||||||||||||
|
Na2HPO4
·2H2O |
3 |
Ромбич., Р222 |
1,034 |
1,364 |
1,698 |
_ |
_ _ |
_ |
_ |
2,066 |
||
|
MnHPO4·3H2O |
3 |
Рbса |
1,0434 |
1,0882 |
1,0219 |
— |
— — |
— |
— |
— |
||
|
Sn2PO4(OH) |
— |
P21
/n |
0,7176 |
0,7051 |
1,0453 |
— |
103,96 — |
4 |
— |
— |
||
|
Zn2HP3O10·6H2O |
5/3 |
Триклинная |
1,0714 |
1,0658 |
0,8391 |
114,51 |
103,21 74,31 |
2 |
— |
— |
||
|
Pb2HP3O10 |
5/3 |
Cm |
0,693 |
1,434 |
0,597 |
— |
135,1 — |
2 |
5,32 |
5,30 |
||
|
Разнокатионные
фосфаты |
||||||||||||
|
KZn2H(PO4)2
·2,5H2O |
3 |
P1 |
0,9109 |
1,3543 |
0,8814 |
102,21 |
113,35 95,92 |
4 |
_ |
_ |
||
|
Mn2Zn(PO4)2
·4H2O |
3 |
Орторомбич. |
1,0647 |
1,8503 |
0,5066 |
— |
— — |
— |
— |
— |
||
|
Li2BaP2O7 |
2 |
Стcm |
0,7078 |
1,2164 |
1,3856 |
— |
— — |
8 |
3,62 |
3,62 |
||
|
NH4BeP3O10 |
5/3 |
Моноклинная C2/c |
1,2200 |
0,8645 |
0,8937 |
— |
117,40 — |
4 |
— |
— |
||
|
NH4Zn2P3O10·7H2O |
5/3 |
— |
1,073 |
0,8474 |
1,0725 |
65,03 |
105,94 102,90 |
2 |
2,08 |
2,14 |
||
|
Na3Mg2P5O16 |
7/5 |
Моноклинная Р2/а |
1,8617 |
0,6844 |
0,5174
©2005-2024 Все права защищены.
Pora.ru При цитировании или републикации ссылка на сайт источника обязательна. Мнение редакции может не совпадать с мнением авторов.
Сетевое издание "Здоровый дух" серия Эл № ФС77-86198 от 27 октября 2023 г., выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций. Учредитель и главный редактор В.В. Горшенин Телефон: +7 (499) 641-41-69 Адрес, e-mail редакции, 105066, Россия, Москва, ул. Старая Басманная, д.16/1Б, [email protected] | |||||||



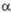 , град
, град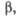 град
град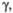 град
град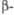 [Cd(PO3)2]n·H2O
[Cd(PO3)2]n·H2O