ФОСФИНОКСИДЫ И ФОСФИНСУЛЬФИДЫ
(фосфинов окиси и тиоокиси), соед. общей ф-лы 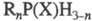 , где R - орг. радикал; X = О, S; n = 1-3. Различают первичные (n
= 1), вторичные (п = 2) и третичные (п = 3) Ф. и ф. Названия соед.
образуются от назв. соответствующего фосфина (напр., Ph3PO -трифенилфосфиноксид,
PhP(S)H2 - фенилфосфинсульфид); вторичные Ф. и ф. наз. также фосфинистыми
и тиофосфини-стыми к-тами соответственно.
, где R - орг. радикал; X = О, S; n = 1-3. Различают первичные (n
= 1), вторичные (п = 2) и третичные (п = 3) Ф. и ф. Названия соед.
образуются от назв. соответствующего фосфина (напр., Ph3PO -трифенилфосфиноксид,
PhP(S)H2 - фенилфосфинсульфид); вторичные Ф. и ф. наз. также фосфинистыми
и тиофосфини-стыми к-тами соответственно.
Третичные Ф. и ф. R3P(X)
наиб. изучены. Они представляют собой бесцв. жидкости или кристаллы; раств.
в орг. р-рителях; низшие фосфиноксиды хорошо раств. в H2O и гигроскопичны.
Большинство третичных Ф. и ф. устойчиво при хранении и нагревании до т-ры кипения;
низшие оксиды выдерживают кратковременное нагревание до 450-700 0C,
сульфиды - до 350-380 0C. Оксиды с a-группой ОН при т-ре выше
100 0C отщепляют карбонильное соединение. Ф. и ф. обычно устойчивы
к гидролизу в нейтральных водных р-рах, медленно гидролизуются в щелочных и
кислых средах.
Третичные Ф. и ф. - высокополярные
соединения 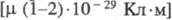 . Энергия связей (в Alk3PX) для P = O и P = S соотв. 565,6-586 и
373,1-398,05 кДж/моль. Конфигурация молекул тетраэдрическая. В ИК спектрах полосы
поглощения связи P = O в области 1100-1330 см -1 [для (CF3)3PO,
Ph3PO, (C4H9)3PO соотв. 1327, 1190
и 1170 см -1], связи P = S 530-640 см -1 [для (CH3)3PS,
(C2H5)3PS и Ph3PS соотв. 558, 535
и 630 см -1].
. Энергия связей (в Alk3PX) для P = O и P = S соотв. 565,6-586 и
373,1-398,05 кДж/моль. Конфигурация молекул тетраэдрическая. В ИК спектрах полосы
поглощения связи P = O в области 1100-1330 см -1 [для (CF3)3PO,
Ph3PO, (C4H9)3PO соотв. 1327, 1190
и 1170 см -1], связи P = S 530-640 см -1 [для (CH3)3PS,
(C2H5)3PS и Ph3PS соотв. 558, 535
и 630 см -1].
Фосфиноксиды более сильные
основания, чем фосфинсу-льфиды, но слабее N-оксидов. Фосфиноксиды образуют с
к-тами НА комплексы или соли [R3POH]+A-. Комплексы
фосфиноксидов с к-тами Льюиса (BF3, SO3, SiHal4)
и солями металлов более устойчивы, чем комплексы фосфинсульфи-дов. В мягких
условиях фосфиноксиды дают с калием ион-радикалы (R3PO-)K+,
тогда как фосфинсульфиды при действии щелочных металлов восстанавливаются до
третичных фосфинов. Известно мн. р-ций с участием фосфорильной P = О и тиофосфорильной
P = S групп, напр.:
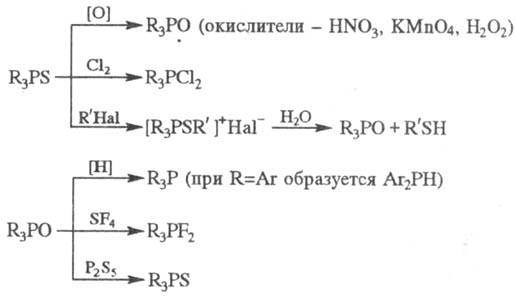
Фосфиноксиды вступают также
во мн. р-ции, не затрагивающие связи P = O, напр.:
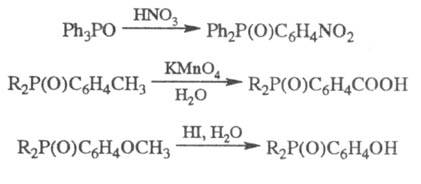
В присут. акцепторов протонов
фосфиноксиды, содержащие активную группу CH2, реагируют с карбонильными
соед. по схеме:
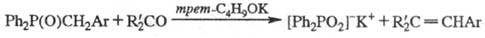
Осн. методы получения третичных
Ф. и ф.: действие RMgHal или RLi на 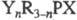 (Y = Hal, OR'; X = O, S; n =1-3); перегруппировка эфиров R2POR
или тиоэфиров R2PSR в присут. I2 либо RHal; присоединение
О или S к третичным фосфинам (окислители - H2O2, N2O4,
S, R2Sn и др.); присоединение
(Y = Hal, OR'; X = O, S; n =1-3); перегруппировка эфиров R2POR
или тиоэфиров R2PSR в присут. I2 либо RHal; присоединение
О или S к третичным фосфинам (окислители - H2O2, N2O4,
S, R2Sn и др.); присоединение 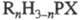 (X = O, S) к соед. с активир. двойной связью (к карбонильным соед., CHR= CHCN
и др.); действие спиртов или меркаптанов на фосфораны R3PHal2;
термич. разложение солей [R4P]+Y- (Y = OH,
OR, OAc; при Y = Hal предварительно обрабатывают NaOH или Ag2O -
H2O); алкилирование P2O4 или элементарного
P с помощью RI с послед, гидролизом солей фосфония.
(X = O, S) к соед. с активир. двойной связью (к карбонильным соед., CHR= CHCN
и др.); действие спиртов или меркаптанов на фосфораны R3PHal2;
термич. разложение солей [R4P]+Y- (Y = OH,
OR, OAc; при Y = Hal предварительно обрабатывают NaOH или Ag2O -
H2O); алкилирование P2O4 или элементарного
P с помощью RI с послед, гидролизом солей фосфония.
ВторичныеФ. и ф. R2P(X)H
- вязкие жидкости или кристаллы, раств. в орг. р-рителях (простейшие фосфиноксиды
смешиваются с H2O), при хранении и нагревании постепенно разлагаются.
Спектральные данные свидетельствуют в пользу тетрагон, конфигурации молекул
вторичных Ф. и ф. [исключение - оксиды и тиооксиды бис-(перфторал-кил)
фосфинов, существующие в виде изомерных фосфини-стых кислот R2PXH
(X= S, O)].
При обработке щелочными
металлами или алкоголятами образуют соли R2POM (фосфиниты); при хлорировании
-хлорангидриды R2P(O)Cl. При действии окислителей (H2O2,
I2 - H2O, KMnO4) фосфиноксиды образуют к-ты
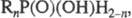 фосфинсульфиды
- смесь к-т [R2P(O)OH и R2P(S)SH]. Во вторичных Ф. и ф.
атом H может быть замещен на Cl действием CCl4 в смеси с NR3.
Большинство соед. рассматриваемого типа способно присоединяться к соед. с кратными
связями (альдегидам, кетонам, амидам и нитрилам,
фосфинсульфиды
- смесь к-т [R2P(O)OH и R2P(S)SH]. Во вторичных Ф. и ф.
атом H может быть замещен на Cl действием CCl4 в смеси с NR3.
Большинство соед. рассматриваемого типа способно присоединяться к соед. с кратными
связями (альдегидам, кетонам, амидам и нитрилам,
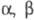 -ненасыщенным карбоновым к-там, азометинам, азинам и др.), напр.:
-ненасыщенным карбоновым к-там, азометинам, азинам и др.), напр.:
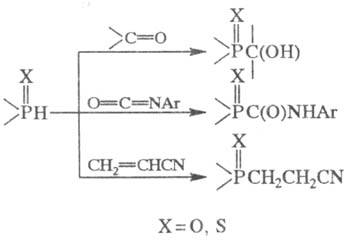
Вторичные Ф. и ф. синтезируют
действием RMgHal на диалкилфосфиты (RO)2P(O)H или (RO)2P(S)H;
р-цией H2O или H2S с R2PY (Y = Cl, NR2);
присоединением O2 (контролируемое окисление) или S к вторичным фосфинам.
Кроме того, вторичные фосфиноксиды можно получать действием LiAlH4
на фосфинаты R2P(O)Y (Y = Cl, OR) и конденсацией PH3 с
2 эквивалентами альдегида или кетона. Препаративное значение имеет синтез вторичных
фосфинсульфидов по схеме:
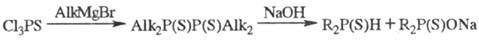
ПервичныеФ. иф. RP(X)H2
- неустойчивые соед.; их получают окислением (напр., с помощью N2O4
или H2O2) первичных фосфинов либо присоединением PH3
к альдегидам или кетонам. Неустойчивые при комнатной т-ре фосфинсуль-фиды RP(S)H2
образуются при смешении в р-рителе первичных фосфинов с серой.
Ф. и ф.- экстрагенты (фосфиноксиды
- для экстракции из р-ров ионов лантаноидов и актиноидов, Ph3PS -
селективный экстрагент Ag из азотнокислых р-ров), присадки к смазочным маслам,
катализаторы, антипирены, реагенты в орг. синтезе.
Лит.: Нифантьев
Э.E., Химия фосфорорганических соединений, M., 1971, с. 307; M ai er L., в кн.:
Topics in phosphorus chemistry, v. 2, N. Y., 1965, p. 43-131; Hays H.,
Peterson D., в кн.: Organic phosphorus compounds, eds. G. Kosolapoff, L. Maier,
v. 3, N. Y., 1972, p. 341; M ai er L., "Organophos-phorus chemistry",
1972, v. 3, p. 55. Г. И. Дрозд.


