ФТОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ,
содержат в молекуле связи С — F. В зависимости от числа атомов F в молекуле
Ф. с. условно разделяют на монофторированные, поли-фторированные и перфторированные
(все атомы H замещены HaF).
Первые Ф. с. были синтезированы
в 19 в., интенсивное развитие химии этих соед. приходится на 40-е гг. 19 в.
Среди Ф. с. представлены аналоги почти всех типов орг. соед.
Введение атома F часто
резко изменяет св-ва орг. соед. Это обусловлено природой атома фтора: его
высокой электроотрицательностью, малым размером атома (ван-дер-ваальсов-ский
радиус всего на 10% больше, чем у H), способностью электронов к разл. типам
сопряжения. Связь C — F характеризуется малым межатомным расстоянием, энергия
связи превышает энергию связей C — H и C — Cl. Оощее св-во Ф. с.- уменьшение
межатомного расстояния с увеличением числа атомов F в молекуле.
При замещении атомов H
на F мол. масса орг. соед. значительно увеличивается, а т-ры кипения и плавления
почти не изменяются (напр., у гексафторбензола т. кип. 80 0C). Перфторалканы
(часто наз. фтору глероды), начиная с C5, кипят при более
низкой т-ре, чем соответствующие алканы. Плотность и вязкость у них выше, а
показатель преломления и диэлектрич. проницаемость ниже, чем у соответствующих
углеводородов. Атомы F изменяют электронную плотность в молекуле Ф. с., что
приводит к изменению кислотных Cв-в и даже к обращению полярности двойной связи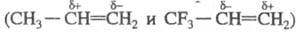 . Высокая энергия связи С — F, а также плотная и объемная оболочка из атомов
F, изолирующая углеродную цепь от внеш. хим. воздействий, способствуют высокой
термо- и хим. стойкости Ф. с.
. Высокая энергия связи С — F, а также плотная и объемная оболочка из атомов
F, изолирующая углеродную цепь от внеш. хим. воздействий, способствуют высокой
термо- и хим. стойкости Ф. с.
В ИК спектрах Ф. с. присутствует
характеристич. полоса при 1300-1000 см-1, соответствующая валентным
колебаниям связи C — F, диапазоны хим. сдвигов Ф. с. в спектрах ЯМР 19F
представлены на рис. В масс-спектрах перфторалкилсо-держащих соед., прежде всего
перфторалканов, фторир. эфи-ров, перфтор-1,3-дикетонов и др., наблюдается пик
иона CF3+ с мол. м. 69. Другие ионы-гомологи, как правило,
не дают интенсивных пиков.
Хим. св-ва Ф. с. определяются
природой углеродного скелета и наличием атома F. Фторуглероды химически инертны
и термически устойчивы. При обычной т-ре они подвергаются только действию Na
в NH3, разлагаются щелочными металлами и SiO2 при 400-500
0C, термич. разложение начинается при 700-800 0C. Также
инертны простые фторир. эфиры и фторир. третичные амины. Ненасыщ. фторир. системы
(фторолефины, гексафторбензол) высокореакционноспособ-ны, причем по характеру
взаимод. с другими соед. они резко отличаются от олефинов и ароматич. соед.
Они легко реагируют
с нуклеоф. соед. (спиртами, аминами, NH3), вступают в р-ции циклодимеризации
и циклоприсоединения, что не типично для олефинов. По отношению к сильным электрофилам
фторолефины ведут себя как нуклеофилы. Реагируют с в-вами, образующими своб.
радикалы (напр., N2O4, FNO, N2F4,
CF3I). Нек-рые фторолефины (напр., тетрафторэти-лен)легко
полимеризуются (см. Фторопласты)-, гексафгор-пропилен не образует гомополимеров,
но сополимеризуется с рядом фторолефинов, перфторизобутилен не полимеризу-ется
и не сополимеризуется.
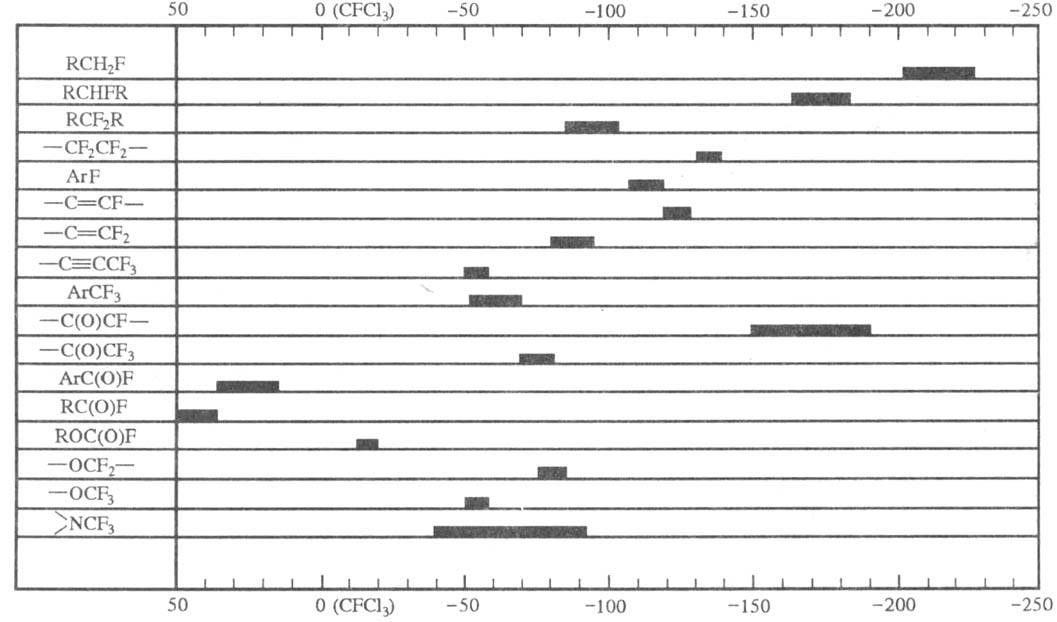
Химические сдвиги в спектрах
ЯМР 19F.
Атом F в молекуле сильно
влияет на св-ва расположенных рядом с ним функц. групп. Карбонильная группа
в частично и полностью фторир. альдегидах и кетонах является электро-нодефицитной,
поэтому эти соед. более реакционноспособны по отношению к нуклеофилам и более
пассивны по отношению к электрофилам, чем их углеводородные аналоги (см., напр.,
Гексафторацетон). Для частично фторир. альдегидов и кетонов характерны
высокое содержание енольных форм и склонность к образованию внутрикомплексных
соед. (см. Полифтор-  дикетоны).
дикетоны).
Первичные и вторичные спирты,
содержащие группу ОН непосредственно у фторир. атома С, как правило, нестабильны;
теряя HF, они превращаются во фторкарбонильные соед. Спирты ф-лы RFCH2OH
(RF - перфторир. радикал) стабильны. Фторир. спирты обладают более
кислыми св-вами, чем их углеводородные аналоги. Благодаря склонности к образованию
водородной связи фторир. спирты образуют прочные комплексы с акцепторами протона
и служат р-рителями для полярных полимеров (см. Спирты полисфторированные).
Гетероатомы (N, О, S),
связанные с фторалкильной группой, теряют большую часть своей основности. Насыщенные
алифатич. и циклич. перфторэфиры, за исключением пер-фторэпоксидов, химически
и термически стабильны; пер-фторэпоксиды высокореакционноспособны (см. Перфтор-олефинов
окиси).
Присутствие атома F в карбоновых
к-тах повышает их кислотность. Так, для CF3COOH рКа
0,23 (для CH3COOH рКа 4,74). Введение атома
F в амины уменьшает их основность. Перфорир. тpeт-амины, подобно перфторир.
эфирам, инертны и
термически стабильны. Они не образуют солей или комплексов с сильными к-тами
и не подвергаются действию большинства окислителей. В перфторир. тpeт-аминах
[напр., N(C4F9)3] хорошо раств. O2,
N2 и CO2, что позволяет использовать их как газопереносящие
среды в рецептурах "искусственной крови".
В ароматич. ядре атом F
направляет заместитель в пара-положение, перфторалкильные группы - в мета-положение.
При р-ции фторсодержащих ароматич. соед. с нуклеофилами сначала замещается один
атом F, а затем второй - в пара-положение
к первому. Пентафгорбензол образует магнийорг. соед., вступающее обычным образом
в р-ции Гриньяра. Из ароматич. соед., содержащих F в боковой цепи, наиб. значение
имеют бензотрифториды, применяемые для синтеза стойких красителей, фармацевтич.
препаратов и пестицидов.
О способах введения атома
F в орг. соед. см. Фторирование.
Атом F благодаря близости
по размеру атому H может имитировать последний в живом организме. Вследствие
этого многие частично фторир. орг. соед. обладают физиол. активностью и используются
при создании новых лек. препаратов и пестицидов. Так, гексафторбензол исследован
как ингаляционный анестетик в ветеринарии; фторбензол, дифторбен-зол, полициклич.
фторароматич. соед.- полупродукты в синтезе фармацевтич. и пестицидных препаратов;
5-фторурацил используется в хемотерапии рака.
Ф. с. применяют во мн.
областях пром-сти: на основе фторопластов получают промышленно важные фторволокна
и фторкаучуки, из фторангидридов карбоновых и сульфокис-лот и олигомеров
гексафгорэтилена - фторированные поверхностно-активные вещества. Ф. с.
используют как стойкие смазочные, антифрикционные, изолирующие, водо- и масло-отталкивающие
материалы; насыщ. алифатич. Ф. с.- хладагенты (см. Хладоны).
Ф. с. служат для изучения
фундам. теоретич. вопросов химии: природы кратной и водородной связи, механизма
р-ций, природы межмол. сил и др.
Лит.: Шеппард У.,
Шартс К., Органическая химия фтора, пер. с англ., M., 1972. А. В. Фокин.


