ФУРАЗАН (1,2,5-оксадиазол),
мол.м. 70,05; бесцв. жидкость; т. кип. 98 оC; 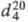 1,1680;
1,1680; 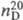 1,4077; хорошо раств. в орг. р-рителях, не раств. в воде; с диметилсульфа-том
и тетрафтороборатом триэтилоксония образует четвертичные соли.
1,4077; хорошо раств. в орг. р-рителях, не раств. в воде; с диметилсульфа-том
и тетрафтороборатом триэтилоксония образует четвертичные соли.
Производные Ф.- бесцв.
жидкости или кристаллы; для 3-фенил-Ф. т. пл. 36-36,5 0C, для 3,4-диметил-Ф.
т. пл. -70C,
т. кип. 1560C.
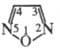
Ф. и его замещенные не
вступают в р-ции с электроф. и нуклеоф. агентами по гетерокольцу, напр, нитрование
или галогенирование арилзамещенных Ф. происходит лишь в ароматич.
кольцо заместителя. Под действием оснований Ф. и его монозамещенные превращаются
в соли оксимов соответствующих 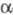 -оксонитрилов:
-оксонитрилов:
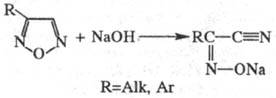
Арилзамещенные Ф. устойчивы
к действию HCl при 200 0C и термич. воздействию, напр. 3,4-дифенил-Ф.
начинает разлагаться лишь при 250 0C с расщеплением связей N-O и
С-3 — С-4 по р-ции:
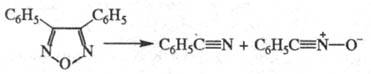
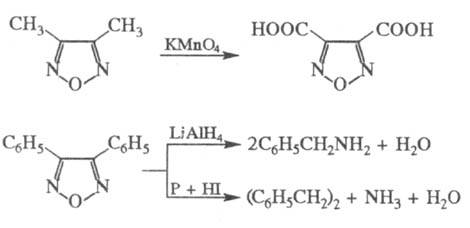
Окисление 3,4-диметил-Ф.
KMnO4 приводит к фура-зан-3,4-дикарбоновой к-те, восстановление моно-
и дизаме-щенных Ф. действием LiAlH4, P + HI, Sn + HCl и др. агентами
- к раскрытию цикла, напр.:
Общий метод синтеза Ф.
и его производных -дегидратация a-диоксимов под действием CuSO4,
уксусного ангидрида, SOCl2, POCl3; a-диоксимы, в свою
очередь, м. б. получены из кетонов, содержащих a-метиленовые группы, a-дикетонов
или фуроксанов:
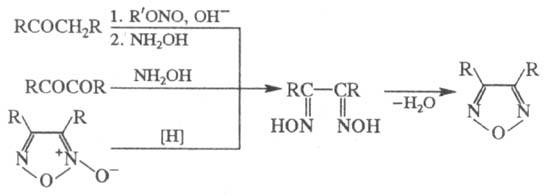
Незамещенный Ф. получают
нагреванием глиоксима с ангидридом янтарной к-ты при 150-170 0C.
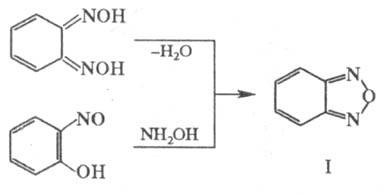
Наиб. изученное конденсированное
производное Ф.- бен-зофуразан (ф-ла I) - синтезируют из диоксима о-хинона или
из oрто-дизамещенных производных бензола по р-циям:
Производные Ф. обладают
противомикробным действием.
Лит.: Гетероциклические
соединения, под ред. P. Эльдерфилда, пер. с англ., т. 7, M., 1965, с. 357-88;
Общая органическая химия, пер. с англ., т. 9, M., 1985, с. 527-30; The chemistry
of heterocyclic compounds, ed. by A. Weiss-berger, v. 17, 1962, p. 283-95; Comprehensive
heterocyclic chemistry, ed. A. P. Ka-tritzky, v. 6, Oxf., 1984, p. 393-426.
/-. д. Швехгеймер, В. И. Келарее.


