ХЛАДОНЫ (фреоны), насыщ. фторуглероды
или полифторуглеводороды (часто содержат также атомы С1, реже - Вr).
Торговые названия X. состоят из фирменного
названия (в России - хладон, в США - фреон, по международному стандарту
- буква R) и цифрового обозначения, в к-ром первая цифра - число атомов
С минус единица (для соед. метанового ряда эта цифра опускается), вторая
- число атомов Н плюс единица, третья - число атомов F (если число атомов
F больше 9, то ставится дефис и далее цифра, указывающая на число атомов
F в молекуле), напр. дифторхлорметан CHF2C1 наз. хладоном 22,
декафторбутан C4Fig - хладоном 31-10. Для X., содержащих атомы
Вr, ставится буква В и цифра, показывающая число атомов Вr, напр. дифторхлорбромметан
CF2ClBr наз. хладоном 12В1. Для циклич. X. перед цифровым обозначением
ставится буква С, напр. перфторциклобутан наз. хладоном С318. При наличии
изомеров цифровое обозначение соответствует наиб. симметричному соед. (наименьшая
разность масс левой и правой частей молекулы), а у последующих, все более
несимметричных, добавляются буквы а, b, с и т. д., напр. 1,1,1-трифторэтан
наз. хладоном 143а. При наличии двойной связи в молекуле X. в качестве
четвертой цифры используют единицу.
X.- газообразные или жидкие в-ва (табл.),
раств. в орг. р-рителях, плохо или практически не раств. в воде; нек-рые
X. образуют кристаллогидраты.
X.- относительно инертны, их хим. превращения
требуют высоких т-р. Пиролиз ряда X. при 600-1150 °С приводит к фторолефинам,
фторпарафинам, галогенам или галогеноводородам (если X. содержит атомы
Н), напр.:
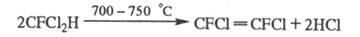
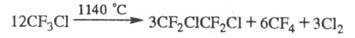
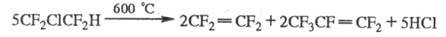
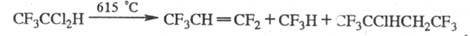
При УФ облучении в присут. О2 X. разрушаются с образованием радикалов, к-рые диспропорционируют до фторкарбонильных соед., фторолефинов, галогенов и др. Хлорсодержащие X. при УФ облучении выделяют атомарный хлор, к-рый взаимод. с молекулами озона:
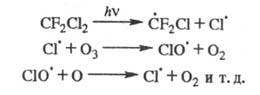
В стратосфере это приводит к снижению концентрации
озона (т. наз. озоновые дыры).
При взаимод. с Н2 X. дегидрогалогенируются
или образуют продукты замещения галогенов на Н; водородсодержащие X. взаимод.
с Вr2 и С12 при высоких т-рах, напр.:
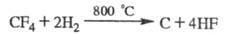
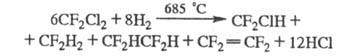
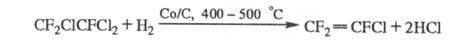
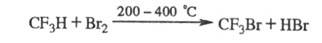
При взаимод. X. с F2 образуется, как правило, смесь продуктов фторирования. X., содержащие С1 или Вr, замещают их на F при р-ции с HF в присут. катализаторов, напр.:
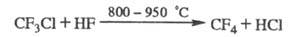
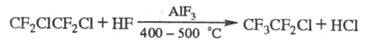
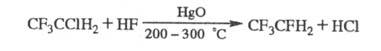
Бромсодержащие X. склонны к термич. распаду, могут ингибировать цепные радикальные процессы (окисление и др.).
Осн. пром. методы получения X.- жидко- или газофазное фторирование хлор- или бромпарафинов фтором, фторидами металлов или безводным HF в присут. галогенидов Sb; диспропорционирование полифторхлоралканов при 150-250 °С в присут. А12О3 или А1С13; хлорирование либо бромирование фторуглеводородов при 500-600 С:
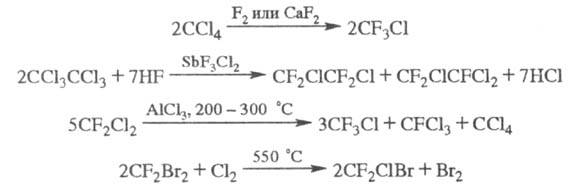
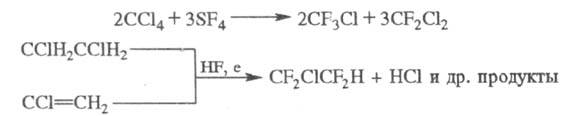
X. могут быть получены также фторированием алканов или алкилгалогенидов SF4 либо электрохим. фторированием алкилгалогенидов или алкенилгалогенидов, напр.:
X.- рабочие тела в пром. и бытовых холодильных
агрегатах и кондиционерах; пропелленты для аэрозолей; порообразователи
при произ-ве пенопластов и пенополиуретанов; инертные р-рители; реагенты
для сухого травления при изготовлении интегральных схем; чистящие средства.
Нек-рые X. применяют для синтеза фтормономеров и др. орг. продуктов. Бромсодержащие
X. используют в огнетушащих составах в качестве ингибиторов пламени и флегматизаторов
горения углеводородов.
В связи с влиянием на стратосферный озон
(X. обнаружены на высоте 15-30 км от пов-сти Земли) пром. применение X.
уменьшается. В 1985 была подписана Венская конвенция по защите озонового
слоя, а в 1987 в Монреале принят Протокол, подписанный всеми основными
странами, производящими X., в к-ром определен перечень озоноактивных X.
и намечены сроки обязат. сокращения объемов их произ-ва. Это хладоны
11, 12, 113, 114, 115, 12В1, 13В1, 114В2. Согласно дополнению, внесенному
в монреальский Протокол в июне 1990, предписывается снизить произ-во указанных
X. к 1995 на 50%, к 1997 на 85% и к 2000 прекратить совсем. Ввиду этого
ведутся разработки новых, экологически безопасных X. (типа 123, 134 и др.),
обладающих необходимыми эксплуатац. св-вами и легко разрушающихся в атмосфере
с образованием малоактивных в-в.
Большинство X.- малотоксичны (нек-рые
раздражают слизистые оболочки глаз и верхних дыхат. путей). Вдыхание воздуха
с большими концентрациями X. может привести к отеку легких. ПДК 1000-3000
мг/м3. Особенно опасно воздействие продуктов разложения нек-рых
X. на горячих пов-стях или в пламени (могут содержать фосген, НС1, HF,
COF2 и др.). Для большинства X. т. самовоспл. выше 600 °С. Мировое
произ-во X. ок. 900 тыс. т в год (1988).
СВОЙСТВА ХЛАДОНОВ
|
Соединение
|
Мол. м.
|
Т. пл., оС
|
Т. кип.,
°С |
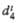 (°С)
(°С) |
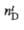 (°С)
(°С) |
tкрит°С
|
dкрит
кг/м3
|
ркрит
МПа |
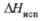
при т. кип., кДж/моль |
cv,
кДж/(кгК) |
Давление пара,
МПа
(20 oC) |
|
|
Хладон 11 CFC13
|
137,37
|
-110,45
|
23,65
|
1,476 (25)
|
1,3824 (20)
|
198,0
|
570,2
|
4,370
|
24,97
|
0,872
|
0,0889
|
|
|
Хладон 12 CF2C12
|
120,91
|
-155,95
|
-29,74
|
1,442 (-15)
|
1,2950 (20)
|
112,0
|
579,1
|
4,119
|
20,01
|
0,972
|
0,5665
|
|
|
Хладон 12В1 CF2ClBr
|
165,36
|
-159,5
|
-4,0
|
1,880 (21)
|
153,7
|
741,0
|
4,252
|
22,26
|
—
|
0,2345
|
||
|
Хладон 12В2 CF2Br2
|
209,82
|
-141,1
|
24,2
|
2,288 (15)
|
1,399 (12)
|
198,85
|
866,4
|
4,335
|
24,86
|
1,034
|
0,0850
|
|
|
Хладон 13 CF3C1
|
104,46
|
-181,0
|
-81,5
|
1,298 (-30)
|
1,1990
(-73,3) |
28,8
|
582,4
|
3,878
|
15,43
|
0,851
|
3,186
|
|
|
Хладон 13В1 CF3Br
|
148,91
|
-174,7
|
-57,8
|
1,538 (25)
|
1,238 (25)
|
66,9
|
770,0
|
3,946
|
17,62
|
0,872
|
1,430
|
|
|
Хладон 14 CF4
|
88,00
|
-183,6
|
-128,0
|
1,638 (-133)
|
1,151 (-73,3)
|
-45,65
|
625,0
|
3,745
|
11,76
|
1,231
|
—
|
|
|
Хладон 21 CHFC12
|
102,92
|
-127,0
|
8,7
|
1,4256 (25)
|
1,3602 (25)
|
178,5
|
528,0
|
5,190
|
24,61
|
1,073
|
0,1531
|
|
|
Хладон 22 CHF2C1
|
86,47
|
-157,4
|
-40,85
|
1,4909 (-69)
|
1,2670 (20)
|
96,13
|
512,8
|
4,986
|
20,19
|
1,110
|
0,9097
|
|
|
Хладон 23 CHF3
|
70,01
|
-155,15
|
-82,2
|
—
|
1,215 (-73,3)
|
25,85
|
525,0
|
4,82
|
16,75
|
—
|
4,193
|
|
|
Хладон 112 CF2C12CFC12
|
203,83
|
26,0
|
92,8
|
1,634 (30)
|
1,4115 (26)
|
285,5
|
550,0
|
3,51
|
30,88
|
—
|
0,0236*
|
|
|
Хладон 112а СF2С1ССl3
|
203,83
|
40,5
|
92
|
1,649 (20)
|
278,0
|
573,0
|
3,34
|
30,57
|
—
|
0,0240*
|
||
|
Хладон 113 CF2ClCFCl2
|
187,38
|
-36,6
|
47,5
|
1,582 (20)
|
1,3588 (20)
|
214,3
|
574,5
|
3,406
|
26,81
|
0,947
|
0,0364
|
|
|
Хладон 114 CF2C1CF2C1
|
170,92
|
-94
|
3,55
|
1,470 (20)
|
1,2865 (25)
|
145,7
|
580,0
|
3,27
|
22,91
|
0,927
|
0,1834
|
|
|
Хладон 114В2
CF2BrCF2Br
|
259,82
|
-110,5
|
47,5
|
2,18 (20)
|
1,3708 (20)
|
214,15
|
790
|
3,358
|
2.6,66
|
—
|
0,0370
|
|
|
Хладон 115 CF3CF2C1
|
154,47
|
-106
|
-38,97
|
*,6914 (-76)
|
1,2678 (-42,2)
|
80,0
|
592,3
|
3,123
|
19,41
|
—
|
0,7909
|
|
|
Хладон 123 CF3CHC12
|
-152,93
|
-107
|
27,1
|
1,475 (15)
|
1,3332 (15)
|
182,0
|
533
|
3,56
|
25,59
|
—
|
0,0778
|
|
|
Хладон 124а CF2C1CHF2
|
136,48
|
-117
|
-12,0
|
126,7
|
521
|
3,47
|
21,59
|
—
|
0,3154
|
|||
|
Хладон 134 CF2HCHF2
|
102,03
|
—
|
-22,5
|
—
|
—
|
110,25
|
477
|
3,77
|
—
|
—
|
0,4737
|
|
|
Хладон 142в CF2ClCH3
|
100,49
|
-130,8
|
-9,2
|
1,120 (25)
|
—
|
136,45
|
459,0
|
4,138
|
22,57
|
—
|
0,2904
|
|
|
Хладон 143а CF3CH3
|
84,04
|
-111,3
|
-47,6
|
0,924 (30)
|
—
|
73,1
|
445
|
4,11
|
19,88
|
—
|
1,187
|
|
|
Хладон 152а CHF2CH3
|
66,05
|
-117
|
-24,55
|
1,004 (-25)
|
1,3011 (-72)
|
113,5
|
365,0
|
4,491
|
21,88
|
—
|
0,5267
|
|
|
Хладон 218 CF3CF2CF3
|
188,02
|
-148,3
|
-36,8
|
1,350 (20)
|
—
|
71,9
|
628
|
2,677
|
20,26
|
—
|
0,7631
|
|
|
Хладон С318 CF2(CF2)2CF2
|
200,03
|
-41,4
|
6,0
|
1,5341 (20)
|
1,217 (25)
|
115,22
|
616
|
2,778
|
22,31
|
—
|
0,2655
|
*При 50 °С
Лит.: Исикава Н., Кобаяси Ё., Фтор. Химия и применение, пер. с япон., М., 1982; Новое в технологии соединений фтора, под ред. Н. Исикава, пер. с япон., М., 1984; Промышленные фторорганические продукты. Справочник, Л., 1990.
И. И. Крылов.


